研究テーマ
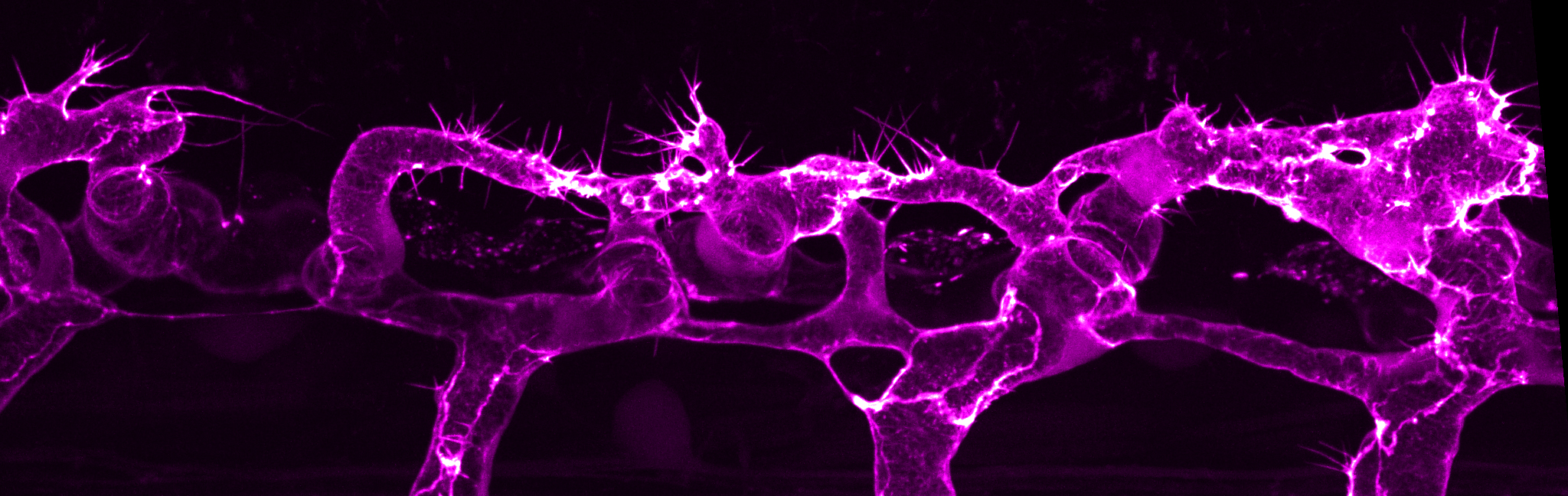
血管は、時間的空間的に厳密に制御された多細胞プロセスである「発芽性血管新生」の過程を経て形成されるのが一般的です。発芽性血管新生では、まず、既存の血管から新たな血管芽が形成されます。血管芽は、低酸素組織に移動する内皮細胞で構成されており、先端の細胞が先導し、茎の細胞がそれに続きます。先端細胞と茎細胞の協調した動きは、細胞間接合部において細胞から細胞に力を伝達するメカノカップリングが媒介しています。また、内皮細胞の広範な形態変化によって、細胞の再配列、血管の吻合、血管内腔の形成が起こります。これらは、いずれも多細胞管状血管網を形成するために不可欠な現象です。
血管形成に重要な分子やシグナル伝達経路は数多く同定されていますが、血管新生促進シグナルと血管新生抑制シグナルがどのように内皮細胞の行動を制御して、正確なサイズと形状の血管を作り、さらに適切にパターン化された血管ネットワークを形成するのかについては、まだ十分に理解されていません。私たちは、ゼブラフィッシュを遺伝学的モデルシステムとして用い、血管の発芽からリモデリングまで、血管の形態形成を支える基本原理を解明しようとしています。特に、アクトミオシン細胞骨格によって生成される内在的な力と、血流などから受ける外因的な力が、内皮細胞の挙動をどのように制御し、血管ネットワークを形成するのかを理解したいと考えています。
血管の形態形成におけるアクチン細胞骨格の動態と機能
当研究室の主な目標は、血管新生時にアクチン細胞骨格の動態がどのように内皮細胞を制御するかを理解することです。私たちはこれまでに、アクチン細胞骨格の動態と局在の違いが細胞行動の違いを引き起こすことを明らかにしてきました。また、フィロポディアにおけるアクチンバンドル(束)の形成が、内皮細胞の効率的な移動と吻合に必要であることも明らかにしました(Phng et al., 2013)。内腔形成の際には、頂端膜に局在するアクトミオシンの収縮力が、血圧によって誘発される膜のへこみを抑え、内腔の拡大を制御します(Gebala et al.、2016)。内皮細胞間の接合部では、ホルミンを介したアクチンフィラメントの集積が接合部の伸長をサポートし、多細胞で構成された血管を安定させます(Phng et al.) さらに当研究室では、細胞皮質のアクチンがどのように膜の動きを調節して内皮細胞の形を誘導するのかを理解し、内皮細胞に特徴的なアクチン構造の形成を制御する分子を特定することをめざしています。
血流の力による機械的刺激に対する内皮細胞の反応
血管の内腔が広がると、内皮細胞は流れずり応力や血圧などの血行力学的な力にさらされます。内腔拡大時には、血圧が内皮細胞の頂端膜を局所的に変形させ、へこみを発生させます(Gebala et al.) これに対し、内皮細胞は修復機構を発動することで変形力に対抗します。このとき、局所的かつ一時的なアクトミオシンがへこみの周りの皮質で活性化され、へこみを後退させ、頂端膜の挙動を正常化します。これによって、血管内腔の拡大を適切に制御します。最近、私たちは、灌流した血管の皮質アクチン細胞骨格の構成が、血流力学的な力に対する内皮細胞の力学的反応を調節する上で重要であることをさらに明らかにしました。線状のアクチン束が過剰に形成されると、内皮細胞の皮質が弱くなり、変形しやすくなって、異所性の膜へこみが起こります(Kondrychyn et al.) 今後、内皮細胞が血行動態の変化をどのように感知して膜や細胞の挙動を変化させるのかを理解することを目指しています。





