
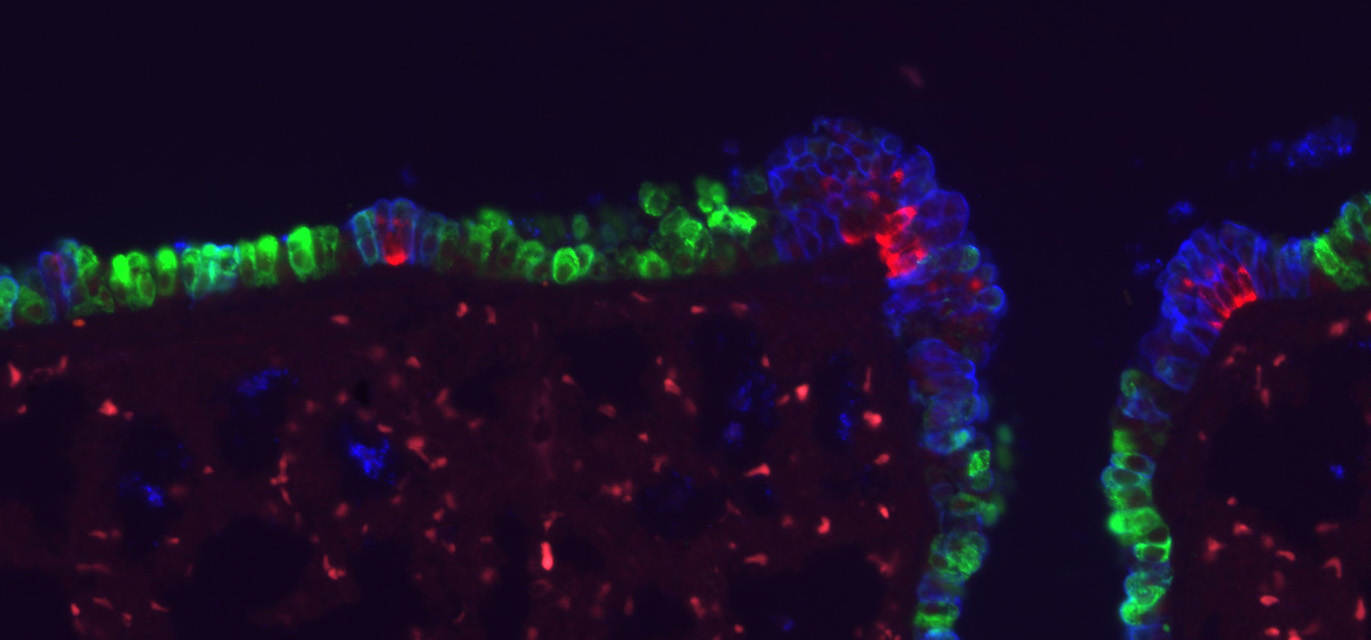
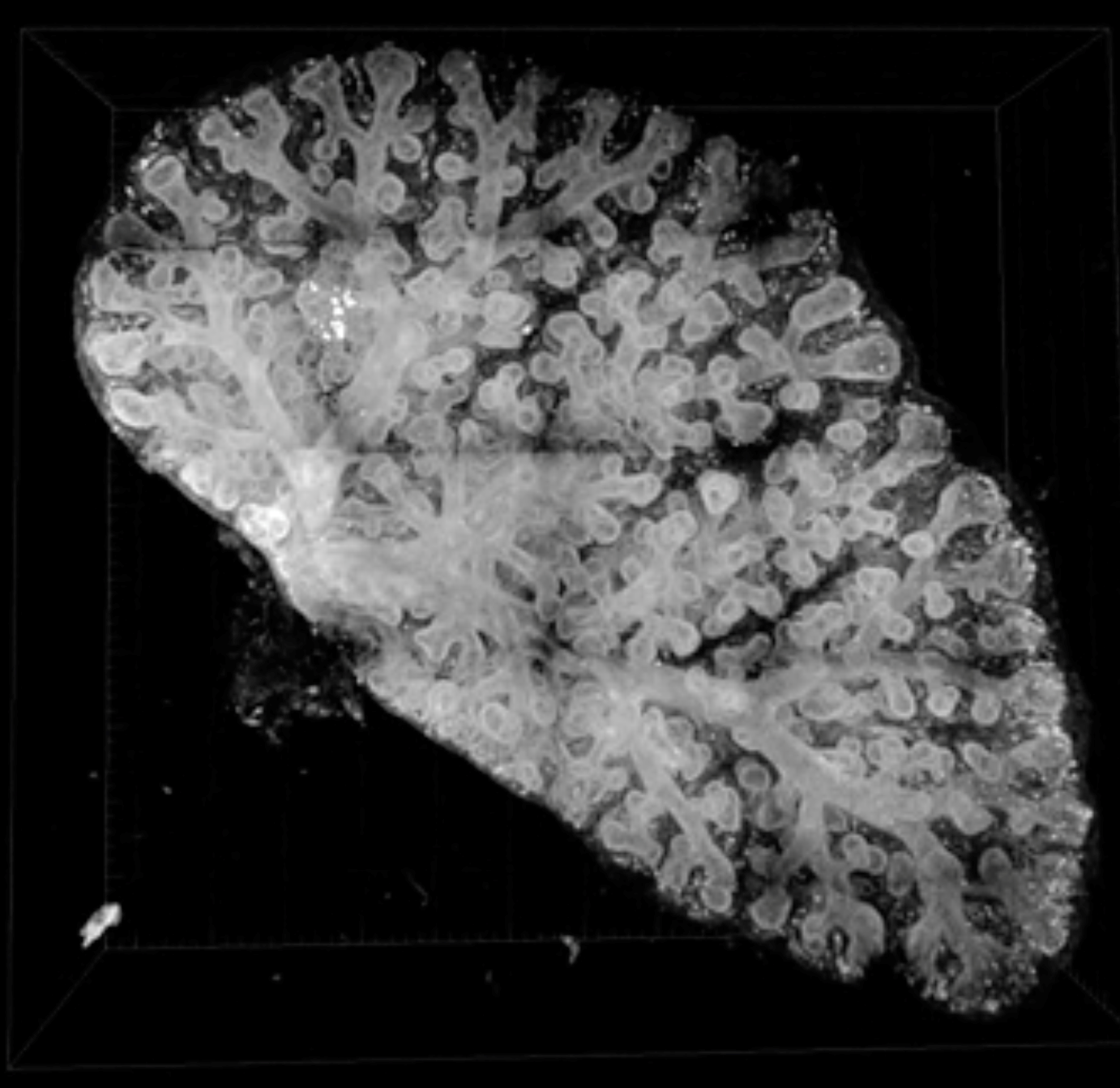
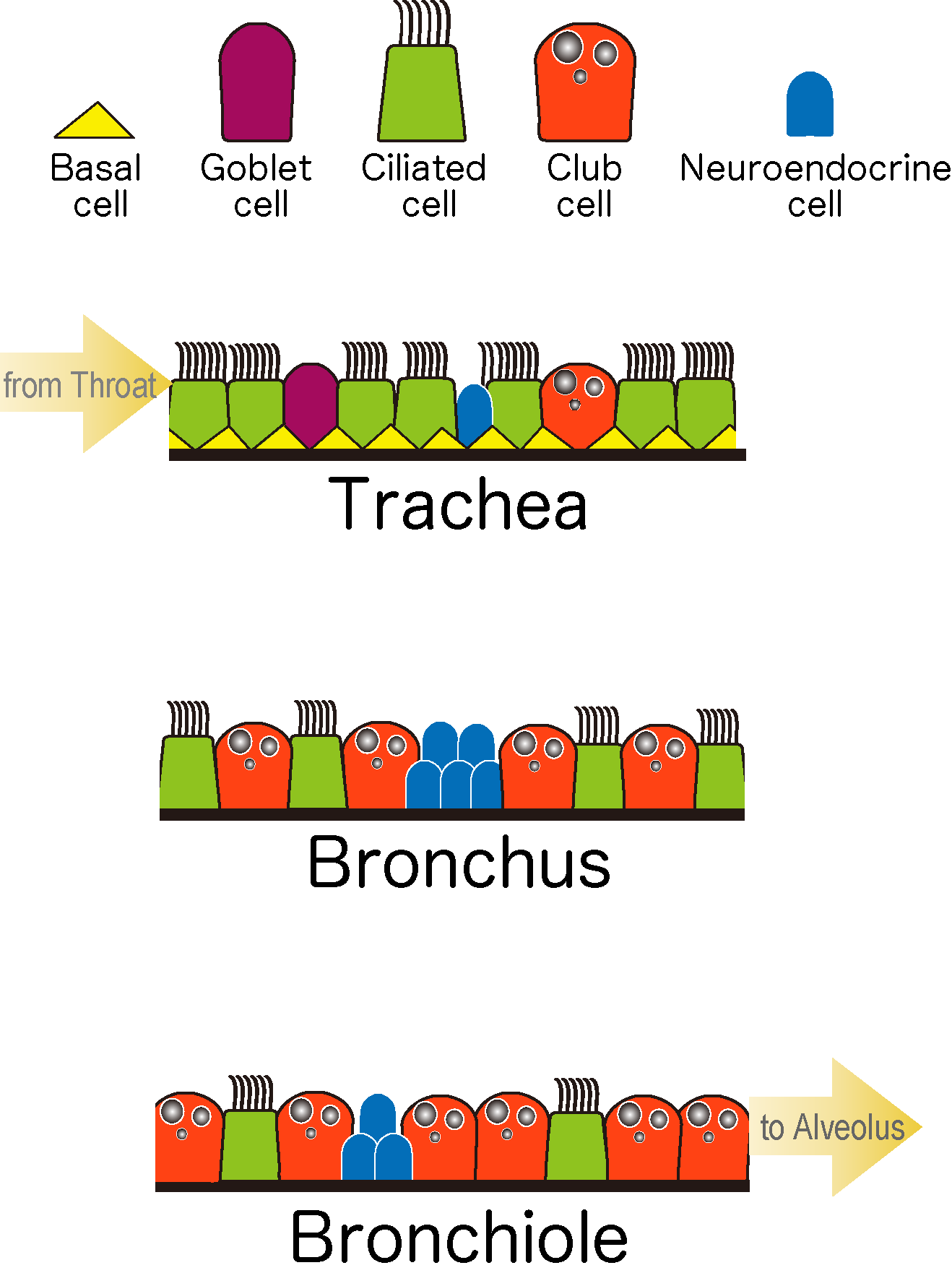
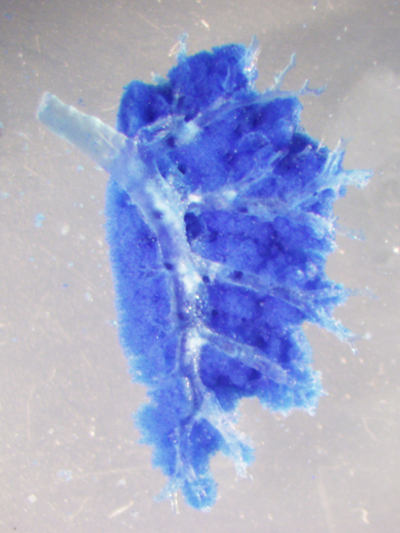
生物の体を構成する臓器は、みな生存に必要な何らかの機能に特化しています。その機能は、各臓器特有の組織構造に分化細胞が適切に配置されることで獲得されます。このような臓器の機能的な形態、細胞能力は発生過程で構築され、特に発生後期~生後初期における臓器の成熟過程は固有の生理機能獲得に重要な時期です。そのため発生過程の臓器形成異常は、疾患と密接に関わっています。一方、生後の体は常に外環境に晒され、組織は頻繁に損傷を受けます。これに対し、人間の臓器も不完全ながら修復・再生能力を持っており、そのメカニズムも徐々に解明されつつあります。私たちは呼吸器の形態形成と、成体における修復・再生現象を題材にして組織形態が幹細胞ニッチ形成に与える影響、発生・再生過程での細胞増殖・分化制御の詳細な機構に注目した研究を行っています。
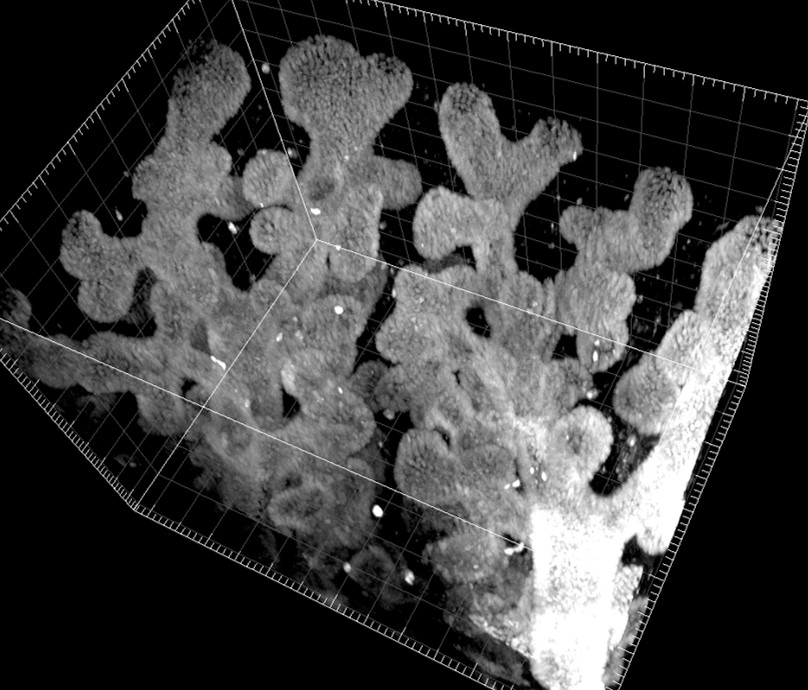
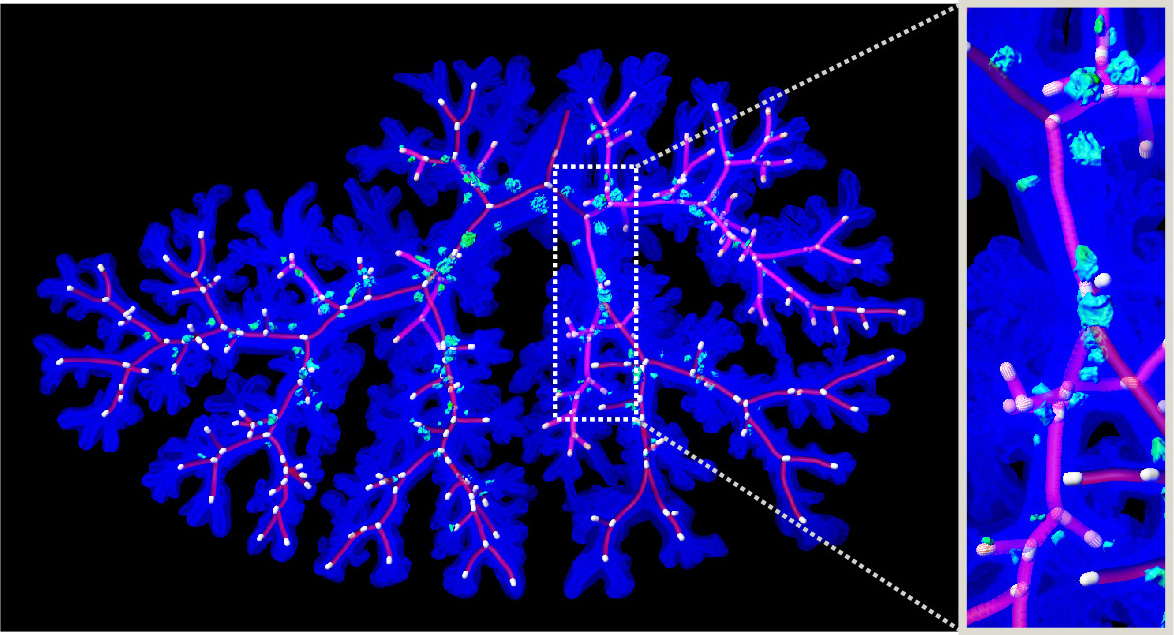
研究テーマ
- 呼吸器の組織形成、再生現象の分子機構の解明
- 組織形態が幹細胞とニッチ形成に与える影響の解明
- 個々の細胞の形態変化と増殖が管腔組織の形態へ与える影響の解析
主要論文
Enomoto Y, Katsura H, Fujimura T, et al.
Autocrine TGF-β-positive feedback in profibrotic AT2-lineage cells plays a crucial role in non-inflammatory lung fibrogenesis.
Nature Communications
14(1), 4956 (2023)
doi: 10.1038/s41467-023-40617-y
Fujimura T, Enomoto Y, Katsura H, et al.
Identifying a Lung Stem Cell Subpopulation by Combining Single-Cell Morphometrics, Organoid Culture, and Transcriptomics.
Stem Cells
41(8), 809-820 (2023)
doi: 10.1093/stmcls/sxad044
Kishimoto K, Iwasawa K, Sorel A, et al.
Directed differentiation of human pluripotent stem cells into diverse organ-specific mesenchyme of the digestive and respiratory systems.
Nature Protocols
17(11), 2699-2719 (2022)
doi: 10.1038/s41596-022-00733-3
Kiyokawa H, Yamaoka A, Matsuoka C, et al.
Airway basal stem cells reutilize the embryonic proliferation regulator, Tgfβ-Id2 axis, for tissue regeneration.
Developmental Cell
56(13), 1917-1929 (2021)
doi: 10.1016/j.devcel.2021.05.016
Kishimoto K, Furukawa KT, Luz-Madrigal A, et al.
Bidirectional Wnt signaling between endoderm and mesoderm confers tracheal identity in mouse and human cells.
Nature Communications
11, 4159 (2020)
doi: 10.1038/s41467-020-17969-w
Kishimoto K, Tamura M, Nishita M, et al.
Synchronized mesenchymal cell polarization and differentiation shape the formation of the murine trachea and esophagus.
Nature Communications
9, 2816 (2018)
doi: 10.1038/s41467-018-05189-2
Tsao P, Matsuoka C, Wei SC, et al.
Epithelial Notch signaling regulates lung alveolar morphogenesis and airway epithelial integrity.
Proceeding of the National Academy of Sciences of the United States of America
113, 8242-8247 (2016)
doi: 10.1073/pnas.1511236113
Noguchi M, Sumiyama K, Morimoto M.
Directed migration of pulmonary neuroendocrine cells toward airway branches organizes the stereotypic location of neuroepithelial bodies.
Cell Reports
13, 2679-2686 (2015)
doi: 10.1016/j.celrep.2015.11.058
Morimoto M, Nishinakamura R, Saga Y, Kopan R.
Different assemblies of Notch receptors coordinate the distribution of the major bronchial Clara, ciliated and neuroendocrine cells.
Development
139, 4365-4373 (2012)
doi: 10.1242/dev.083840
Morimoto M, Liu Z, Cheng HT, et al.
Canonical Notch signaling in the developing lung is required for determination of arterial smooth muscle cells and selection of Clara versus ciliated cell fate.
Journal of Cell Science
123, 213-224 (2010)
doi: 10.1242/jcs.058669
Morimoto M, Kopan R.
rtTA toxicity limits the usefulness of the SP-C-rtTA transgenic mouse.
Developmental Biology
325, 171-178 (2009)
doi: 10.1016/j.ydbio.2008.10.013
Morimoto M, Takahashi Y, Endo M, Saga Y.
The Mesp2 transcription factor establishes segmental borders by suppressing Notch activity.
Nature
435, 354-359 (2005)
doi: 10.1038/nature03591
ニュース

2025年1月10日 BDRニュース
研究人十色
環境の変化を強みに変えて、異なる視点をつなぐ架け橋になる

2024年3月14日 BDRニュース
理研栄峰賞、理研梅峰賞の授与について
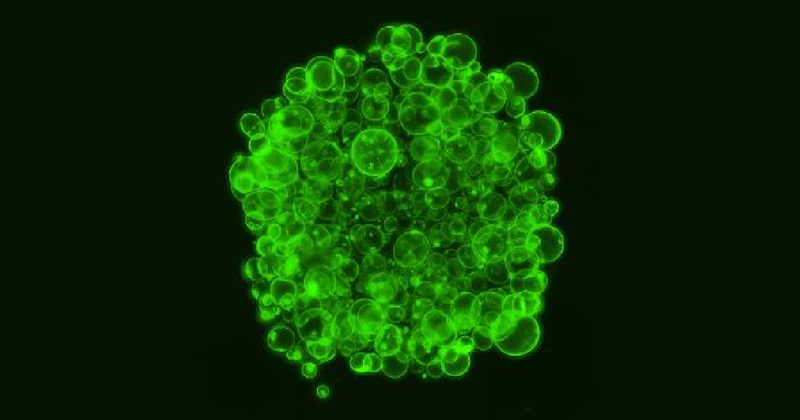
2023年8月31日 研究成果
肺線維症発症の中心的機構を発見
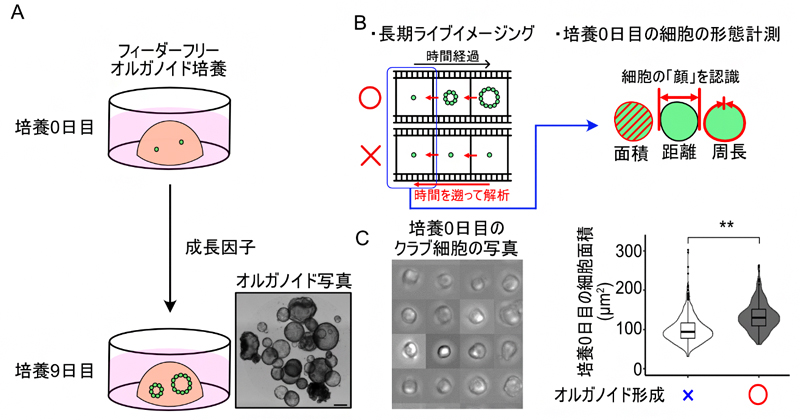
2023年7月20日 研究成果
肺に存在する新たな幹細胞の発見
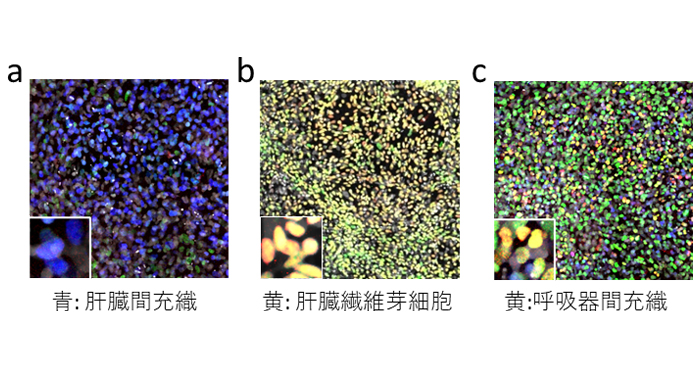
2022年8月18日 研究成果
ES/iPS細胞からのヒト臓器の間充織細胞作製法

2021年10月28日 研究成果
VATER症候群に類似する新規モデルマウスの作製に成功
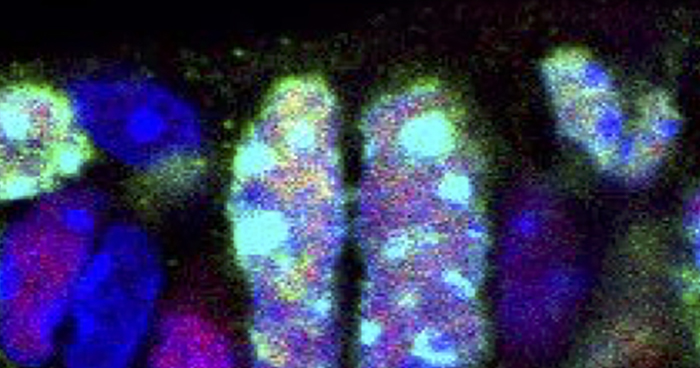
2021年6月15日 研究成果
マウス胎児の中に見つけた呼吸器再生のヒント
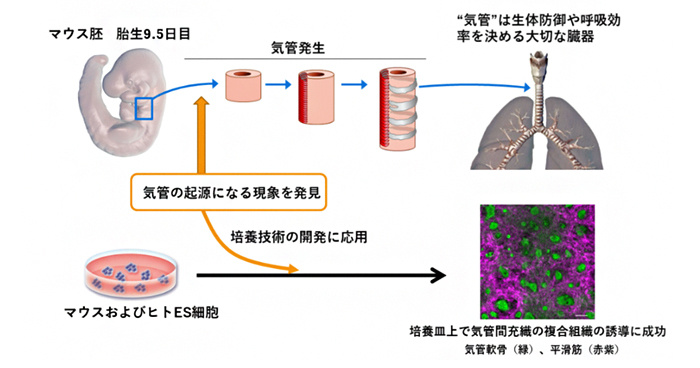
2020年8月27日 研究成果
呼吸器の発生をつかさどるメカニズムの解明

2019年5月31日 BDRニュース
BDRの研究ネホリハホリ
肺の研究は洞窟探検
2018年8月27日 BDRニュース
論文ノート
太くて長い管ができるしくみ
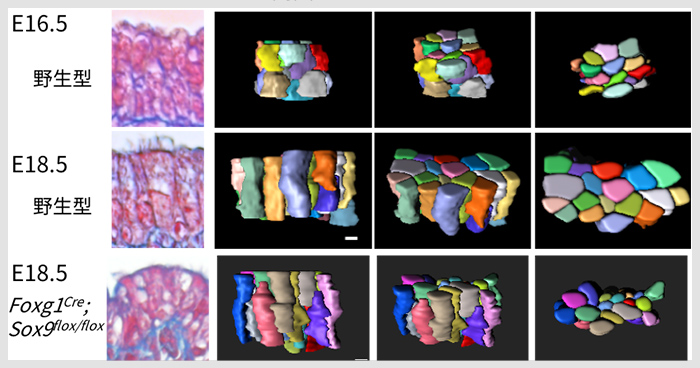
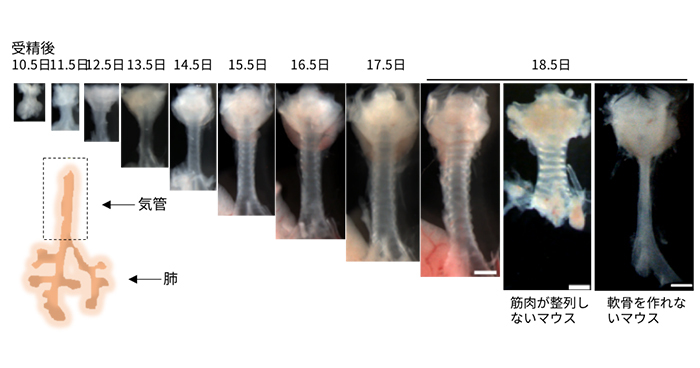
2018年8月6日 研究成果
筋肉の隊列と軟骨の出現が気管を長く太くする
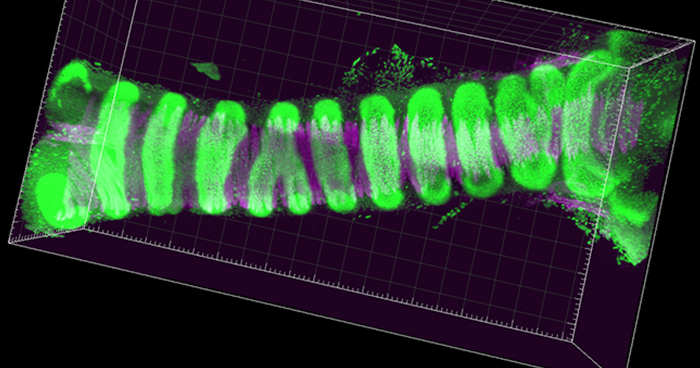
2018年7月26日 研究成果
管腔臓器の長さと太さが決まる仕組みを解明






