
チームディレクター
嶋田 一夫
Ph.D.
生体分子動的構造研究チーム
[2025年4月よりBDRから生命医科学研究センター(IMS)に所属が変わりました]
拠点横浜
E-mail ichio.shimada@riken.jp
膜タンパク質は生体内において重要な役割を果たすとともに最大の創薬標的タンパク質です。また近年は、医薬品開発における創薬標的の枯渇を解消する新たな可能性として、RNA への注目も高まっています。X 線結晶構造解析などはその立体構造解析に大きく貢献してきましたが、得られた立体構造は基本的に静的スナップショットであり、膜タンパク質やRNAなどの生体分子が機能している状態の動的構造や分子間相互作用を必ずしも反映していません。核磁気共鳴法(NMR)はこのような生体分子のin situでの動的構造情報を得ることができる分光法です。そこで本研究チームでは、生物学的に重要な生体分子を対象として、NMR を用いてその機能発現の構造基盤を解明します。
研究テーマ
- 動的構造に基づく生体分子の機能発現機構の解明
- 動的構造に基づくGPCRのシグナル伝達機構の解明
- 脂質二重膜中の膜タンパク質の動的構造解析法の開発
- 高分子量生体分子に適用可能なNMR解析法の開発
主要論文
Toyama Y, Shimada I.
Quantitative analysis of the slow exchange process by 19F NMR in the presence of scalar and dipolar couplings: applications to the ribose 2'-19F probe in nucleic acids.
Journal of Biomolecular NMR
78(4), 215-235 (2024)
doi: 10.1007/s10858-024-00446-7
Kaneko S, Imai S, Uchikubo-Kamo T, et al.
Structural and dynamic insights into the activation of the μ-opioid receptor by an allosteric modulator.
Nature Communications
15, 3544 (2024)
doi: 10.1038/s41467-024-47792-6
Toyama Y, Shimada I.
NMR characterization of RNA binding property of the DEAD-box RNA helicase DDX3X and its implications for helicase activity.
Nature Communications
15, 3303 (2024)
doi: 10.1038/s41467-024-47659-w
Imai S, Suzuki H, Fujiyoshi Y, et al.
Dynamically regulated two-site interaction of viral RNA to capture host translation initiation factor.
Nature Communications
14, 4977 (2023)
doi: 10.1038/s41467-023-40582-6
Shiraishi Y, Shimada I.
NMR Characterization of the Papain-like Protease from SARS-CoV-2 Identifies the Conformational Heterogeneity in Its Inhibitor-Binding Site.
Journal of the American Chemical Society
145, 16669-16677 (2023)
doi: 10.1021/jacs.3c04115
Kaneko S, Imai S, Asao N, et al.
Activation mechanism of the μ-opioid receptor by an allosteric modulator.
Proceedings of the National Academy of Sciences
119(16), e2121918119 (2022)
doi: 10.1073/pnas.2121918119
Shiraishi Y, Kofuku Y, Ueda T, et al.
Biphasic activation of β-arrestin 1 upon interaction with a GPCR revealed by methyl-TROSY NMR
Nature Communications
12, 7158 (2021)
doi: 10.1038/s41467-021-27482-3
Iwahashi Y, Toyama Y, Imai S, et al.
Conformational equilibrium shift underlies altered K+ channel gating as revealed by NMR.
Nature Communications
11, 5168 (2020)
doi: 10.1038/s41467-020-19005-3
Mizukoshi Y, Takeuchi K, Tokunaga Y, et al.
Targeting the cryptic sites: NMR-based strategy to improve protein druggability by controlling the conformational equilibrium.
Science Advances
6(40), eabd0480 (2020)
doi: 10.1126/sciadv.abd0480
Imai S, Yokomizo T, Kofuku Y, et al.
Structural equilibrium underlying ligand -dependent activation of β2 -adreno receptor.
Nature Chemical Biology
16, 430-439 (2020)
doi: 10.1038/s41589-019-0457-5
Shimada I, Ueda T, Kofuku Y, et al.
GPCR drug discovery: integrating solution NMR data with crystal and cryo-EM structures.
Nature Reviews Drug Discovery
18(1), 59-82 (2019)
doi: 10.1038/nrd.2018.180
メンバー
ニュース

2025年3月14日 BDRニュース
理研栄峰賞、理研梅峰賞、理研桜舞賞の授与について

2024年10月18日 BDRニュース
研究最前線
GPCRの「動き」を操るアロステリック調節薬
2024年5月13日 研究成果
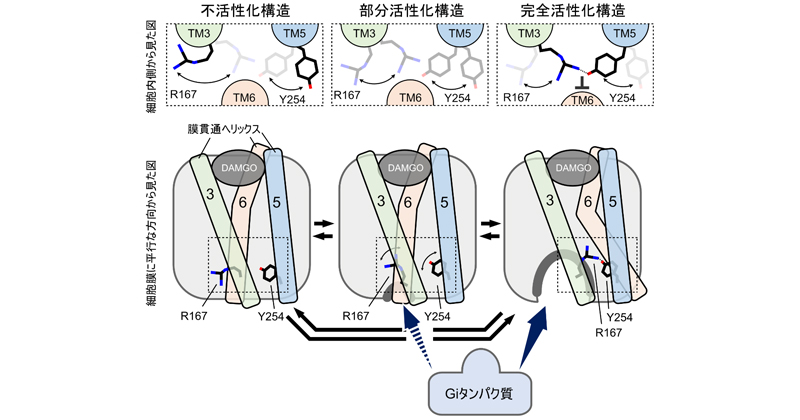
アロステリック調節薬が構造平衡を変えて効く仕組み
2024年4月25日 研究成果
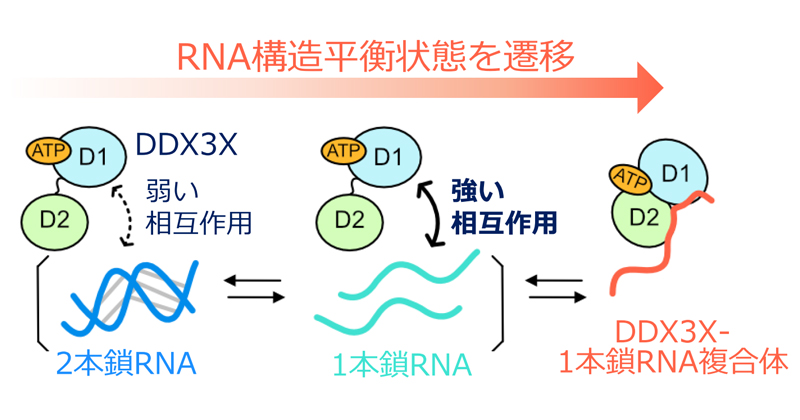
RNAの高次構造をほどく分子機構
2023年8月28日 研究成果
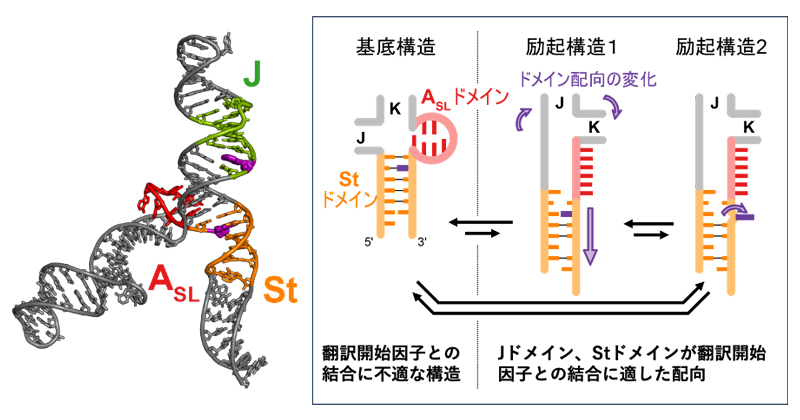
脳心筋炎ウイルスはRNAの動的構造平衡を利用して増える
2023年7月31日 研究成果
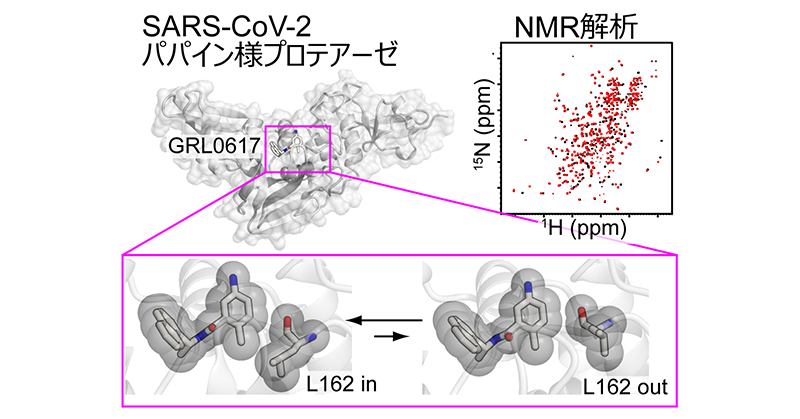
新型コロナウイルスパパイン様プロテアーゼの構造柔軟性
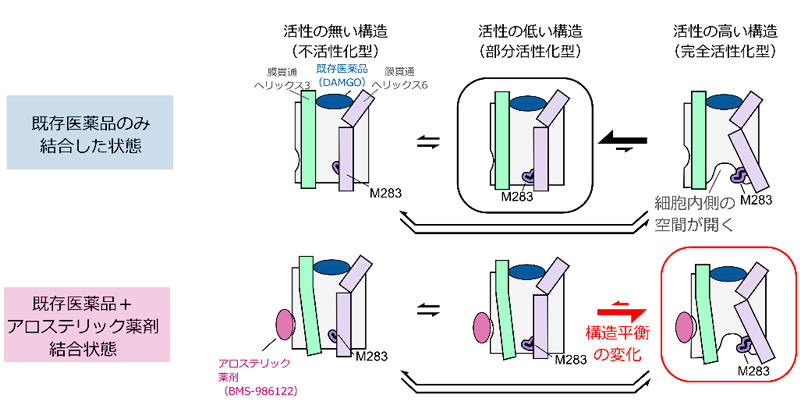
2022年4月12日 研究成果
アロステリック薬剤はタンパク質の構造平衡を変化させる
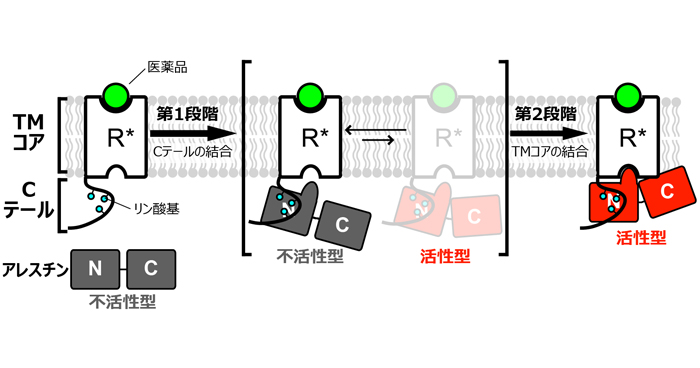
2021年12月13日 研究成果
シグナル伝達複合体の2段階活性化

2021年7月9日 研究成果
オートファゴソームを効率よく作る仕組みを発見
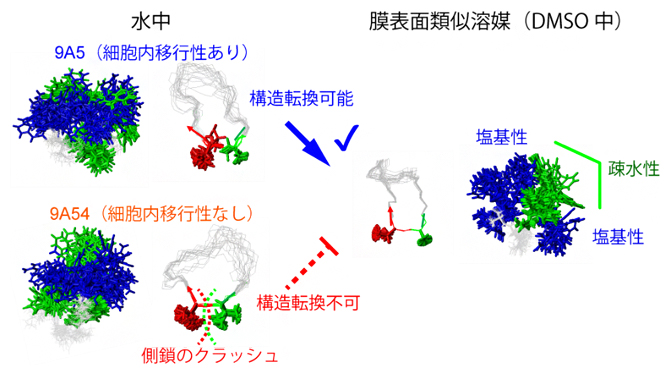
2021年2月16日 研究成果
環状ペプチドは立体構造を変えて細胞に入る
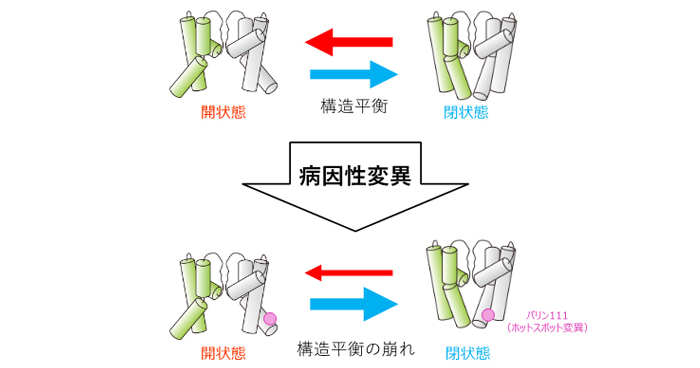
2020年11月13日 研究成果
細胞内ゲートを閉ざす構造平衡の崩れ

2020年8月20日 BDRニュース
嶋田一夫チームリーダーが着任





