研究 | 栄養応答研究チーム
はじめに
我々は生まれてから死ぬまでほぼ毎日、食事をとります。あらゆる動物において、成長し、老化していく過程において常に外環境からの栄養取り込みを必要とします。我々の健康寿命は、摂取する食事の質及び量によって大きく左右されますが、その詳しい分子機構の理解は立ち遅れています。当研究室では、発生・発達・成長・生殖・老化の各ライフステージにおける各種栄養素の生理機能や、動物の栄養過不足に対する適応機構を研究しています。一過的あるいは慢性的な栄養バランスの乱れが、代謝生理、組織恒常性、摂食行動、ストレス応答、生殖能力、そして健康寿命に影響する分子機構を解明することを目指しています。
これまでの生物医学は、いかに病気を治すか、あるいは、病気にならないかということを目指してきたように思います。しかし、健康であることと病気でないことは、似ているようで違います。生物には本来的に健康になろうとする力があるように思います。その力の機械論的な仕組みを紐解き、外部環境としての栄養の変化に対する精緻な適応機構を明らかにすることで、生命の本質的な理解につながるのではと考えます。


我々が利用しているのは、寿命が短く遺伝学・栄養学の優れたモデル生物であるショウジョウバエです。ショウジョウバエは飼育も安価で扱いが容易、倫理的な問題も少なく、数をこなさなければならない寿命測定には最適です。生物の普遍的かつ基本的なメカニズムを知るには、シンプルな生き物を利用するのが得策です。そこで得られた知見をほ乳類に適応することを目指し、霊長類マーモセットでの研究にも挑戦しています。これらにより、ヒトの健康増進、老化抑制、寿命延伸に資する栄養介入法の開発を目指します。
1. 食餌制限による寿命延長機構解明
昔から「腹八分目」とはよく言ったもので、食べ過ぎが良くないことは理解されています。多くのモデル生物においても、食事(餌)を制限することによって健康寿命延長が可能であることが示されており、その機構の解明が進んでいます。その結果、食餌制限の効果の多くは、摂取するタンパク質から供給されるアミノ酸が鍵となっていることが分かっています。しかし、アミノ酸がどうやって体内で感知され、その低下によって身体を構成する様々な細胞にどのような影響が起こるのかの全貌は理解されていません。また、いつどのような状況でアミノ酸の量や代謝状態が変化するのか、アミノ酸制限による健康寿命延長はどうやって起こるのかについては不明な点が多く残されています。実際のヒトの健康寿命が延ばせるのか、どのような状況でどれぐらいアミノ酸を制限すれば良いのか、など疑問はつきません。
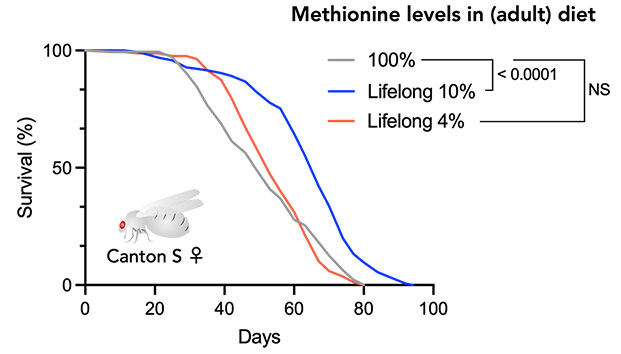
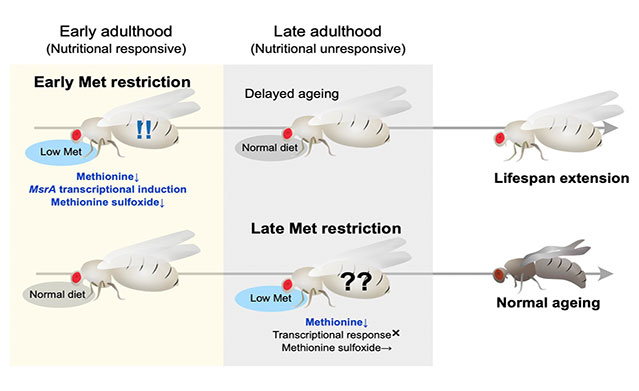
必須アミノ酸であるメチオニンは寿命との関連が多く報告されており、餌からメチオニン摂取を制限することで寿命が延長することが分かってきました。我々の研究室では、ショウジョウバエを利用してメチオニンをはじめとしたアミノ酸が個体寿命を延長するメカニズムや、その有効範囲を明らかにしようとしています。その中でメチオニン制限による寿命延長は若齢期に限定的であり、加齢にともなってその効果が衰えることが分かりました(Kosakamoto, Obata et al., Nat Commun, 2023、プレスリリース)。若齢期(ショウジョウバエ寿命8~10週のうちの最初の4週間)のみメチオニン制限をしておくと、その後通常の餌で飼育しても寿命延長が起こることが明らかとなりました。このように食餌制限の効果は年齢に依存することが分かってきました。なぜ加齢によって栄養応答が変わるのか、若齢期の栄養条件が不可逆的に及ぼす影響とは何か、ヒトや哺乳類などにも当てはまるかなど、疑問は尽きません。メチオニン以外のアミノ酸も寿命に関連することが分かっていますので、その効果も解析しています。また、他の栄養素の摂取がメチオニン代謝に影響することも明らかとなってきており、複雑な栄養応答機構を一つ一つ紐解いているところです。
2. 栄養素の特異的感知とその欠乏に対する適応機構の解明
我々が日々食事から摂取する分子(栄養素)は1万種を超え、10万種とも言われます。それらを適切に摂取することは非常に困難であるように思われますが、生物にはそれぞれの栄養素を特異的に感知し、適応する機構が備わっていると考えられます。例えば、ある栄養素が不足した場合にはその消費・分解を抑え、可能であれば生合成を促進します。また食欲を刺激してその栄養素を摂取するよう行動(嗜好性)を変化させることも考えられます。しかし、その性質において多岐にわたる栄養素のそれぞれを特異的に感知し、その過不足に対する適応機構の多くは不明です。
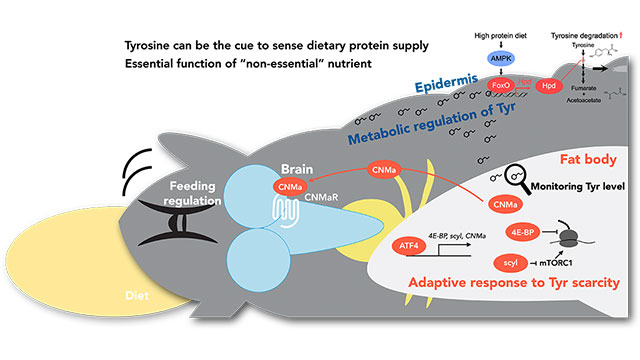
我々の研究室ではこれまでに、発生過程のショウジョウバエに比較的マイルドなタンパク質制限食を与えた場合に起こる適応機構を解明してきました。その結果、成長に強い悪影響が出ないようなタンパク質条件でも、エネルギーやアミノ酸の消費が激しい翻訳の低下や、摂食行動の増強などが起こることを見出しました。そのメカニズムは、食餌から摂らなくても構わないとされている非必須アミノ酸の一種である「チロシン」が重要であることを突き止めました(Kosakamoto et al., Nat Metab, 2022、プレスリリース)。チロシンの欠乏は脂肪組織でATF4と呼ばれる転写因子を制御して、低タンパク質食への適応機構を発動することが分かりました。さらに、チロシン代謝分解についても、タンパク質摂取に応じて強く制御されることも分かってきました(Kosakamoto et al., Development, 2024、プレスリリース)。チロシン代謝分解はFoxOと呼ばれる転写因子を介して活性化されますが、それは上皮組織で起こることも明らかとなりました。このように一つの栄養素に対する感知や適応の仕組みは様々な臓器で異なる分子機構によって制御されており、極めて複雑であることが明らかとなってきました。我々はアミノ酸のみならず、ビタミンやミネラルについても研究を進めており、それぞれの栄養素に特異的な機構の存在を見出しつつあります。
3. 発生・発達期の食環境による健康寿命伸縮機構の解明
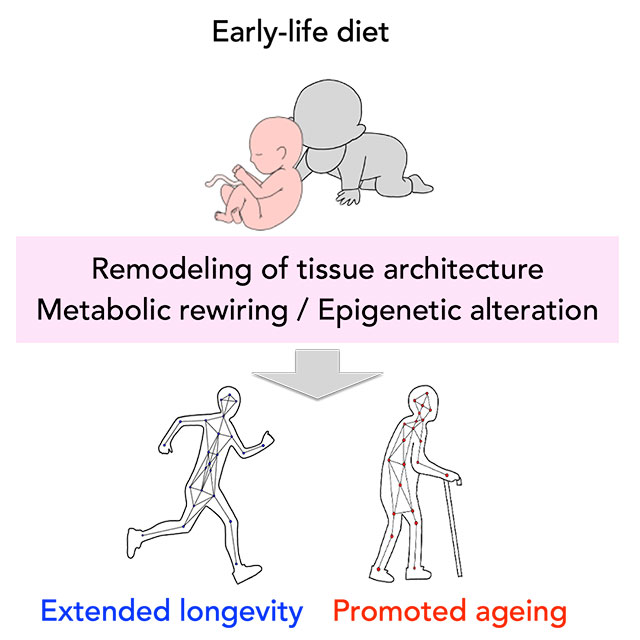
発生・発達過程(早期ライフステージ)における栄養や環境ストレスが何らかの形で個体に記憶され、成体の生理的な状況や老化過程に影響する可能性が示唆されています。このような仮説はDOHaD(Developmental Origins of Health and Disease)と呼ばれ、早期ライフステージの環境により成人の生理機能や生活習慣病のリスクを“プログラム“する機構(栄養プログラミング)があるとして、注目されています。しかしながら、DOHaD研究には、原因と結果の間にある長大な時間的ギャップがあるため、研究に大変時間がかかります。ライフサイクルの短いショウジョウバエは、発生期の食環境によって健康寿命がどう影響するかを解析するのに適しています。
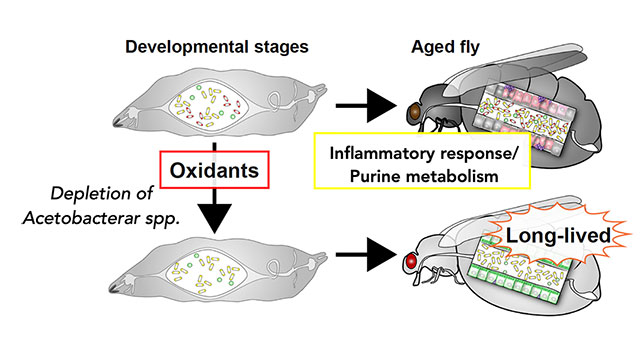
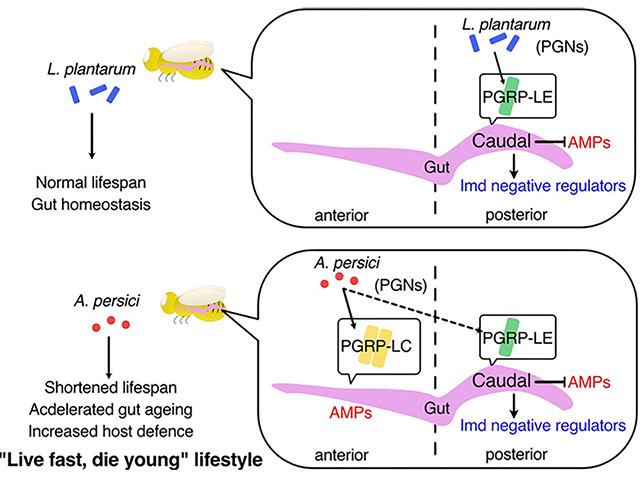
これまでに発生中(幼虫期)のショウジョウバエに低濃度の酸化剤を摂取させると、代謝や免疫が変化し個体寿命が延長する事が分かっていました(Obata et al., Nat Commun, 2018, Yamauchi et al., iScience, 2020)。この寿命延長の原因を解析したところ、腸内細菌組成が不可逆的に変化していることが分かり、特にAcetobacter属細菌が生涯にわたって除去されることが重要であることを見出していました。最近、Acetobacter属細菌の細胞壁を構成するペプチドグリカンが、免疫経路を介して個体の健康寿命を短縮させることを見出しました(Onuma et al., PLoS Genet, 2023、解説記事)。一方、当該細菌は経口感染や酸化ストレスに対する抵抗性を増強させることも分かり、ショウジョウバエにとって「太く短い」生活様式を促進することが示唆されました。腸内細菌は私たちの体の大部分を占めており、健康状態を左右しますが、そのメカニズムにはまだまだ不明な点が多く残されています。当研究室では、腸内細菌による免疫活性化や腸内細菌が作る代謝物が宿主に与える影響を解明しようとしています。また、様々な栄養条件において腸内細菌が持つ機能にも着目し研究を進めています。
一方、早期ライフステージでの栄養欠乏・制限によっても個体寿命が伸縮することが分かっており、そのメカニズムについても研究しています。特にタンパク質の増減が個体の成長のみならず、その後の健康寿命にどのような影響を与えるかについては不明な点が多いため、ショウジョウバエや高等動物での解析を進めています。