チームリーダー
岩根 敦子
Ph.D.
細胞場構造研究チーム
[2023年3月 終了]
E-mail atsuko.iwane[at]riken.jp
[at]を@に変えてください
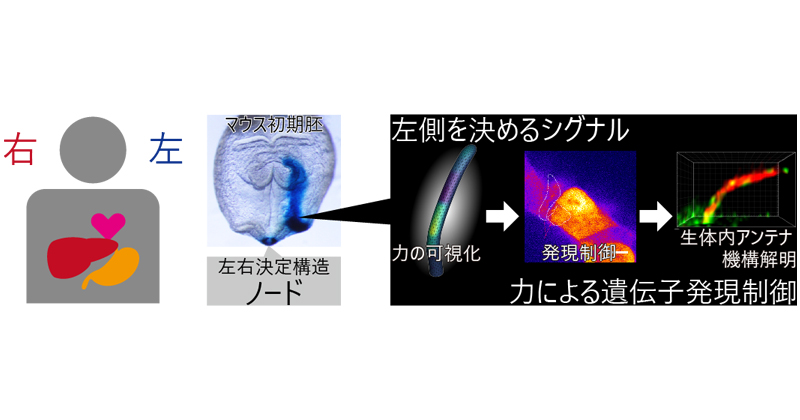
当研究室では細胞内超微細構造を電子顕微鏡観察し、細胞分裂、分化、発生などの状態における細胞場と標的超分子や小器官のダイナミックスを光学顕微鏡などと共同して明らかにする研究開発をしたいと考えています。具体的にはクライオTEM-Tomographyを用いて光学顕微鏡だけでは観察出来ない細胞内の標的超分子や小器官とそれを取り巻く環境を化学固定・染色せずに生きた状態に限りなく近い状態を保持しながら高分解能観察します。また、FIBとSEMが同一チャンバーに取り付けられたDualBeam装置を用いて、試料のスライス加工と断面SEM観察を交互に行い、そこで得られた2次元の連続SEM像をコンピュータによって三次元再構築し、X線トモグラフィーと電子線トモグラフィーの間の分解能で組織・細胞内の標的物とそれを取り巻く環境を丸ごと観察します。
研究テーマ
- クライオ電子顕微鏡を用いた生細胞の無染色イメージング法の開発
- 集束イオンビーム加工ー走査電子顕微鏡と3D再構成系による細胞丸ごと構造解析
主要論文
Mizuno K, Shiozawa K, Katoh TA, et al.
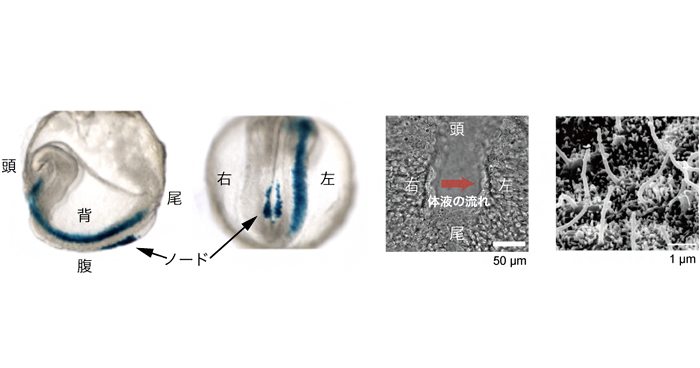
Role of Ca2+ transients at the node of the mouse embryo in breaking of left-right symmetry.
Science Advances
6, eaba1195 (2020)
doi: 10.1126/sciadv.aba1195
Miyamoto T, Hosoba K, Itabashi T, et al.
Insufficiency of ciliary cholesterol in hereditary Zellweger syndrome.
The EMBO journal
39(12), e103499 (2020)
doi: 10.15252/embj.2019103499
Fujii T, Iwane AH, Yanagida T, Namba K.
Direct visualization of secondary structures of F-actin by electron cryomicroscopy.
Nature
467(7316), 724-728 (2010)
doi: 10.1038/nature09372
Nishikawa S, Arimoto I, Ikezaki K, et al.
Switch between Large Hand-Over-Hand and Small Inchworm-like Steps in Myosin VI.
Cell
142(6), 879-888 (2010)
doi: 10.1016/j.cell.2010.08.033
Watanabe TM, Yanagida T, Iwane AH.
Single molecular observation of self-regulated kinesin motility.
Biochemistry
49, 4654-4661, (2010)
doi: 10.1021/bi9021582
Iwane AH, Morimatsu M, Yanagida T.
Recombinant alpha-actin for specific fluorescent labeling.
Proceedings of the Japan Academy Series B-Physical and Biological Sciences
85(10), 491-499 (2009)
doi: 10.2183/pjab.85.491
Iwaki M, Iwane AH, Shimokawa T, et al.
Brownian search-and-catch mechanism for myosin-VI steps.
Nature Chemical Biology
5(6), 403-405 (2009)
doi: 10.1038/nchembio.171
Iwane AH. Tanaka H, Morimoto S, et al.
The neck domain of myosin II primarily regulates the actomyosin kinetics, not the 10.1016/j.jmb.2005.08.013stepsize.
Journal of Molecular Biology
353, 213-221, (2005)
doi: 10.1016/j.jmb.2005.08.013
Tanaka H, Homma K, Iwane AH, et al.
The motor domain determines the large step of myosin-V.
Nature
415, 192-195, (2002)
doi: 10.1038/415192a
Kitamura K, Tokunaga M, Iwane AH, Yanagida T.
A single myosin head moves along an actin filament with regular steps of 5.3 nanometres.
Nature
397, 129-134, (1999)
doi: 10.1038/16403
Iwane AH, Funatsu T, Harada Y, et al.
Single molecular assay of the individual ATP turnovers by a myosin-GFP fusion protein expressed in vitro.
FEBS Letters
407, 235-238, (1997)
doi: 10.1016/S0014-5793(97)00359-1
Iwane AH, Kitamura K, Tokunaga M, Yanagida T.
Myosin subfragment-1 is fully equipped with factors essential for motor function.
Biochemical and Biophysical Research Communications
230, 76-80, (1997)
doi: 10.1006/bbrc.1996.5861