Fam60aはメチル化を制御して遺伝子発現を変化させる
2018年11月1日
DNAメチル化はエピジェネティクスの重要な反応であり、胚発生に重要な役割を果たしている。遺伝子がメチル化されるとクロマチン構造が変化したり、転写因子の結合が阻害されたりして、その発現は抑制されることが多い。特にがんでは異常なメチル化の亢進によって遺伝子のサイレンシングが起こっていることが明らかにされている。また、胚発生においては細胞系列特異的なメチル化パターンによって細胞分化にも重要な役割を果たすと考えられている。
理研BDRの濱田博司チームリーダー(個体パターニング研究チーム)らは、胚の発生に重要な役割を果たすFam60aのノックアウトマウスは内臓の形成不全によって胎生致死となることを示した。また、Fam60aが転写抑制複合体であるSin3a/Hdacと相互作用し、転写開始部位近辺のメチル化を維持することに関与していることを明らかにした。本成果は科学誌eLifeに2018年8月2日付で掲載された。
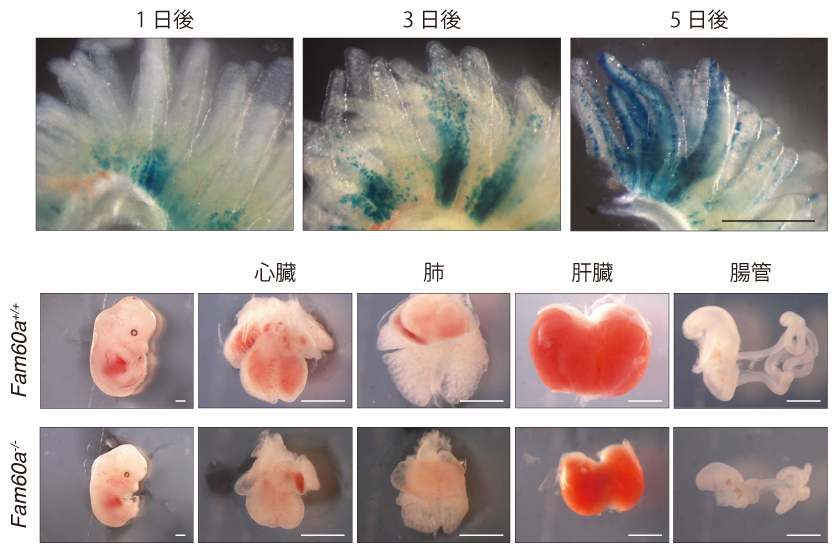
図1. (上)Fam60aは十二指腸の陰窩で発現しており、小腸上皮に分化しながら小腸の絨毛を覆うように移動する(スケールバー500μm) (下)Fam60aノックアウトマウスでは、内臓の低形成によって胎生致死となる(スケールバー1mm)
Oct3/4は多能性幹細胞が多能性を維持するために必須の転写因子として知られる。研究チームは今までに胚性幹細胞(ES細胞)においてOct3/4の下流で働く遺伝子について解析を行い、複数の多能性維持に必要な遺伝子を同定してきた。Fam60aはそのような遺伝子の一つで、ES細胞で高発現している一方、分化後の細胞ではその発現が抑制されている遺伝子である。しかしその機能については構造から類推することは難しく、未知であった。
そこで濱田らは、まず、発生中のマウス胚におけるFam60aの発現パターンを調べた。E9.5ではFam60aは遍在していたが、発生が進むにつれて発現する細胞は限定されていき、E15.5では腸管の上皮細胞や絨毛で高発現していた。また、細胞分裂が活発な十二指腸の陰窩では成体マウスでもFam60aの発現は維持されていた。陰窩におけるFam60a+細胞の運命を追跡すると、絨毛の基部に存在していた細胞が、徐々に絨毛の先端に向かって移動していく様子が観察された。さらに、Fam60aノックアウトマウスを作成したところ、E18.5で胎生致死であった。E13.5で胎児を観察すると内臓器官の多くが低形成であり、特に心臓形成に異常が大きかった。したがって、Fam60aはマウスの発生に重要な役割を担っていることが示唆された。
次に、Fam60a::Venus BACトランスジェニックマウスを作成し、Fam60a-Venusの局在を解析したところ、E9.5の胚において核に局在していた。このトランスジェニックマウスの胚抽出物を用いてFam60aと相互作用するタンパク質を検出したところ、Sin3/Hdac(ヒストン脱アセチル化酵素)コリプレッサー複合体を構成するSin3AおよびHdac1と結合することがわかった。Sin3a/Hdacは転写の抑制制御に関与する分子であるため、Fam60aも転写制御に関与しているのではないかと考えられた。実際にFam60a-/-胚におけるRNAシークエンス解析を行うと、558個の遺伝子の発現が上昇し、172個の遺伝子の発現が減少したので、Fam60aは主に遺伝子の発現を負に制御していると考えられた。さらにChIPシークエンスによってFam60aが転写開始部位の近辺に結合していることがわかった。
では、Fam60aはどのように転写を制御しているのだろうか。Fam60aの有無を多くの生物で調べてみると、Fam60aは進化的に保存されており、DNAのメチル化を担うTetやDnmt1/2/3と似たような保存パターンを示すことがわかった。そこで実際にFam60aノックアウトマウスの胚におけるメチル化の有無を調べてみると、Fam60aが結合するプロモーター領域におけるメチル化がFam60aの欠損によって変化していることが明らかとなった。つまり、Fam60aは発生に必要な遺伝子のプロモーター領域のメチル化を維持することで、発生に必要な遺伝子の発現を制御していることが示唆された。
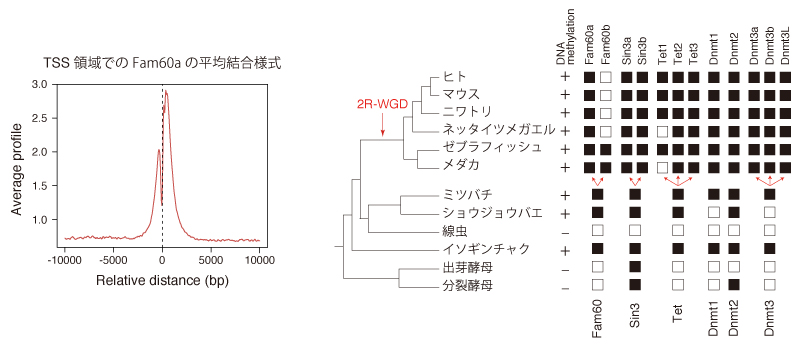
図2. (左)Fam60aは転写開始部位の近くに結合している。(右)TetやDmntなどのDNAメチル化に関連する遺伝子と進化的な保存パターンが似ている。
「Fam60aはDNAのメチル化を制御することで多能性を維持している可能性が示唆されました。Fam60aは成体になったマウスにおいても小腸の陰窩にある幹細胞で発現しており、成体における幹細胞の多能性を維持することに関与しているのではないかと考えています。」と濱田チームリーダーは語る。「Fam60aは成体の脳でも発現している可能性があり、神経幹細胞など、大人の体の中にある幹細胞でFam60aが発現しているかどうかを明らかにしたいと思っています。」
高橋 涼香(BDR・広報グループ)
関連リンク
掲載された論文





