遺伝暗号を人工的につくる
2021年3月18日
最も単純な暗号は、暗号表を用いて、ある文字を別の文字に変換することで作成される。暗号表が知られてしまえば、元のメッセージは解読されてしまう。したがって、頻繁に暗号表を変更するのが、解読を困難にするための常套手段だ。生物学者は50年以上前に遺伝情報を解読するための暗号表を解明した。 今日では、その暗号表自体を変える技術を手に入れつつある。
遺伝暗号を解読する暗号表の役割を担っているのがトランスファーRNA(tRNA)だ。メッセンジャーRNA(mRNA)の遺伝情報をタンパク質のアミノ酸配列に変換する翻訳反応の際に重要な役割を果たしている。理研BDRの清水義宏チームリーダー(無細胞タンパク質合成研究チーム)は、東京大学の上田卓也教授らと共同で、試験管内で人工的に合成されたtRNAを用いて、翻訳の分子機構を再構築することに成功した。さらに、tRNAの構造を改変することで、自然界には存在しない遺伝暗号表を作り出すことが可能であることを示した。この成果は、科学ジャーナル Communications Biologyに掲載された。
遺伝情報をタンパク質のアミノ酸配列に変換するための遺伝暗号表においては、mRNAの4つの塩基(A、C、G、U)の配列は3つごとに「コドン」として解釈され、コドンの一つ一つがアミノ酸の種類を規定している(図1A)。細胞内には数多くの種類のtRNAが存在し、コドンを認識するための「アンチコドン」と呼ばれる3つの塩基からなる配列が含まれており、さらに、それぞれのアンチコドンに対応したアミノ酸が結合している(図1A)。タンパク質の合成工場であるリボソームではmRNAのコドンの並びにしたがって相補的なアンチコドンを持つtRNAが順次取り込まれる。そのtRNAに結合したアミノ酸に、伸長中のペプチド鎖が移され、その結果、ペプチド鎖が伸長し、さらに折り畳まれて機能を持つタンパク質が生成される。このようにして、コドンとアミノ酸の間を媒介するtRNAによって、遺伝子の塩基配列がタンパク質のアミノ酸配列に「翻訳」される(つまり暗号解読される)。したがって、tRNAは、遺伝情報をアミノ酸に変換する暗号表の実体であるといえよう。
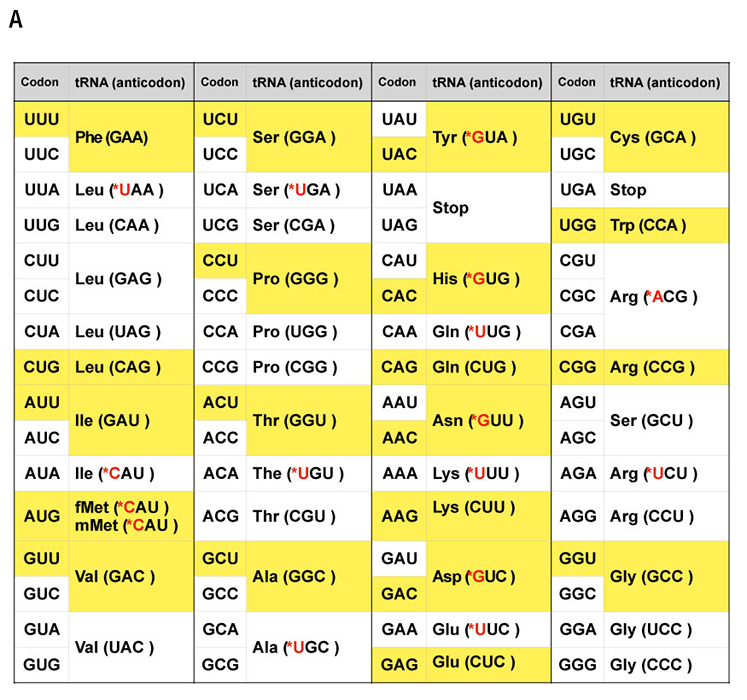
アンチコドンとコドンは完全に1対1対応ではなく、一つのアンチコドンが複数のコドンと結合しうる。また、同じアミノ酸を運ぶ、アンチコドンの異なる複数のtRNAが存在するため、大腸菌の場合、合計で41種類のtRNAが関与している(図1A)。
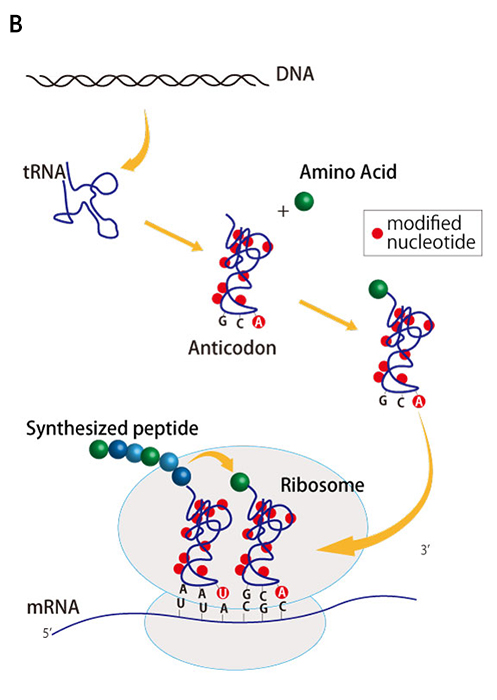
大腸菌の翻訳装置には、多くのタンパク質とRNAの複合体が関与している。清水らの研究グループが開発したPUREシステムでは、精製したこれらの分子複合体を試験管のなかで混ぜ合わせることによって、人工の翻訳装置を実現している。ここでは大腸菌から抽出した41種類のtRNAを用いているが、これらは試験管内で転写された人工tRNAでは代用できないこともわかっている。これは、天然のtRNAを構成する塩基の多くはメチル化などの化学修飾を受けており、場合によってはアンチコドンの周辺の化学修飾がコドン認識に不可欠であるからだ(図1B)。このような化学修飾を試験管内で再現することは容易ではないため、研究チームは、化学修飾を受けなくても機能するか、あるいは比較的機能低下が少ないtRNAを選択した(図1Aで黄色くハイライトしたtRNA)。
その結果、化学修飾なしでも機能する21種類の人工tRNAを天然のtRNAの代わりにPUREシステムに組み込むことによって、すべてのアミノ酸種を翻訳することができた。この最小限の遺伝暗号表に基づいてジヒドロ葉酸還元酵素(DHFR)のDNA配列を再設計し、それをテンプレートとすることによって、活性を持つ酵素タンパク質の試験管内合成に成功した。
さらに清水らは、コドンとアミノ酸の関係、すなわち遺伝暗号表を実験的に上書きできることを示した。
清水らは、アラニン-tRNAのアンチコドンGGCを、遺伝子工学的にCGAに置き換えた。CGAに対応するコドンであるUCGは本来セリンを意味するコドンの一つであるが最小限の遺伝暗号表では使われない、いわば予備のコドンだ。これにアラニンを割り当てた。その結果、天然ではセリンを意味するコドンUCG(アンチコドンはCGA)は、この人工系ではアラニンと解釈される。一方、天然のアラニンコドン(GCUとGCC)は無効になる。清水らはこの遺伝暗号表に基づいて、すべての天然のアラニンコドン(GCUとGCC)を新しいアラニンコドン(UCG)で置換したDNAテンプレートを使って、この新しい合成系で翻訳させ、機能的なDHFRを生成することに成功した。一方、同じDNAテンプレートを用いて、天然型の翻訳系でDHFRを合成させるとアラニンであるべきアミノ酸が全てセリンになってしまうため、合成されたタンパク質は不活性になることも示した。
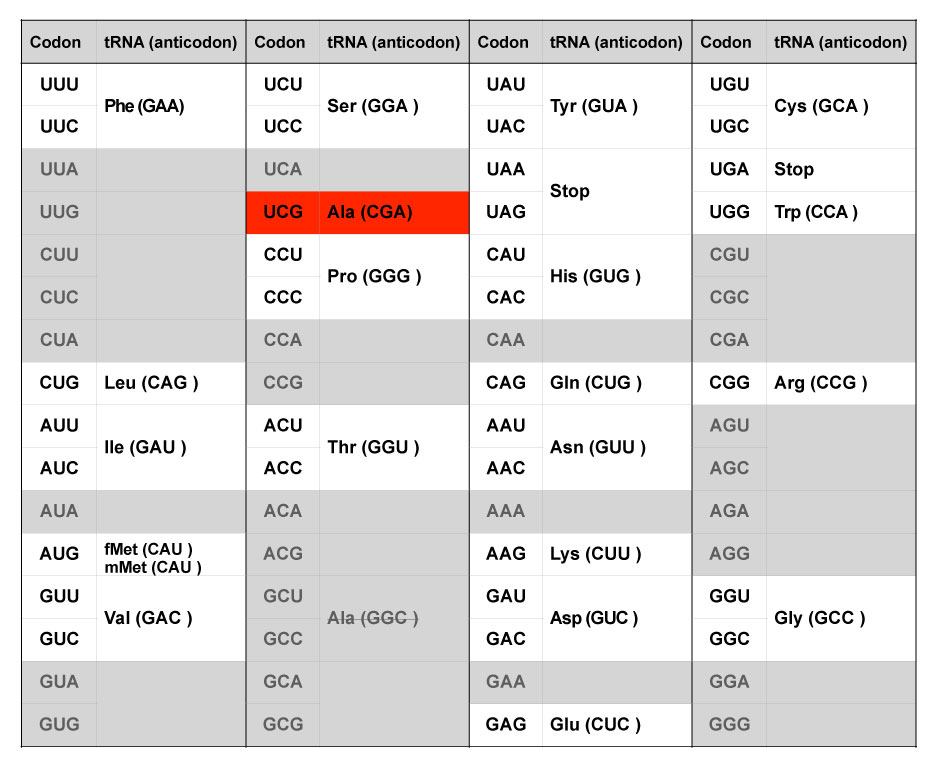
コドンUCG(天然ではセリンに対応する予備のコドン)をアラニンに割り当てるようにtRNAを改変した。一方、天然ではアラニンに対応するコドンGCUとGCCは暗号表から除いた。
さらに清水らは、コドンとアミノ酸の関係、すなわち遺伝暗号表を実験的に上書きできることを示した。
清水らは、アラニン-tRNAのアンチコドンGGCを、遺伝子工学的にCGAに置き換えた。CGAに対応するコドンであるUCGは本来セリンを意味するコドンの一つであるが最小限の遺伝暗号表では使われない、いわば予備のコドンだ。これにアラニンを割り当てた。その結果、天然ではセリンを意味するコドンUCG(アンチコドンはCGA)は、この人工系ではアラニンと解釈される。一方、天然のアラニンコドン(GCUとGCC)は無効になる。清水らはこの遺伝暗号表に基づいて、すべての天然のアラニンコドン(GCUとGCC)を新しいアラニンコドン(UCG)で置換したDNAテンプレートを使って、この新しい合成系で翻訳させ、機能的なDHFRを生成することに成功した。一方、同じDNAテンプレートを用いて、天然型の翻訳系でDHFRを合成させるとアラニンであるべきアミノ酸が全てセリンになってしまうため、合成されたタンパク質は不活性になることも示した。
人工遺伝暗号表は応用面でも大きな意義をもつ。コロナウイルスの研究は急務であるが、危険なウイルスタンパク質の研究でもある。人工的な遺伝暗号表に基づいてウイルスの遺伝子を再設計し、それをテンプレートとして試験管内でウイルスタンパク質を合成し研究に用いれば、万が一、DNAが環境中に流出して天然の微生物やウイルスに取り込まれ、タンパク質として合成されても、アミノ酸配列が本来の配列とは異なってしまうため、タンパク質としては正常に機能しない可能性が高い。
清水チームリーダーは「さらに改良すれば、病気の原因となる遺伝子(コロナウイルスのタンパク質など)が実験室の外では完全に無害化されるような実験系を設計できると考えています。また、無細胞システムを使うこと自体が、組換え生物を作らないという意味で、生物環境の汚染を防ぐことになると思います。」と今後の期待を語る。
川野 武弘(BDR・広報グループ)
関連リンク
掲載された論文





