体節時計を再現し、脊椎肋骨異形成症の病態モデルをつくる
2020年4月3日
背骨や肋骨は繰り返し構造でできている。これはからだのかたちが形成される時期に、「体節」という構造が首から腰にむかって順番に1つずつ形成されていくことに由来する(図1)。この正確な繰り返しパターンのかたちづくりを制御している仕組みが体節時計だ。体節時計は、正しいタイミングで正しい大きさの体節を作るために重要な仕組みだ。だから、体節時計が壊れると脊椎や肋骨が正常に形成されない病気「脊椎肋骨異形成症(SCD)」を引き起こす。体節時計の異常はどのようにこの病気に関係しているのだろうか。それを解析するために、試験管の中に体節時計という発生過程を再現することを目指した。
理研BDRの松田充弘研究員(研究当時、再構成生物学研究ユニット、戎家美紀ユニットリーダー)と京都大学、理研IMS、名城病院の研究グループ*1は、ヒトiPS細胞を用いて体節時計をもつ組織を試験管内で再現し、この組織が脊椎肋骨異形成症の原因遺伝子を解析するための病態モデルとして有効であることを明らかにした。本成果は科学誌 Nature に2020年4月1日付で掲載された。
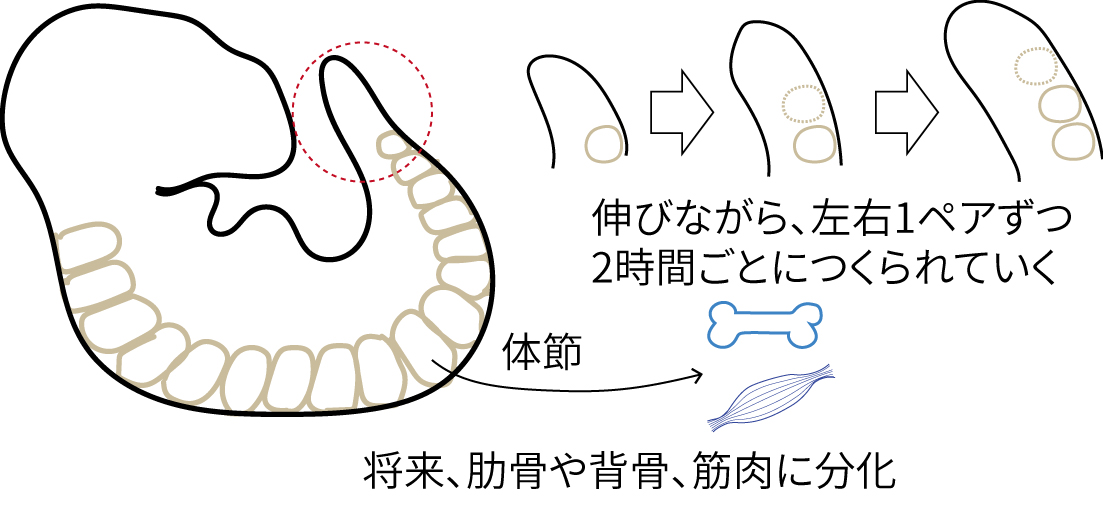
図1 体節ができていく様子。体節形成は体節時計に制御されていて、正しい位置に正しい大きさで
正しいタイミングで形成される。体節形成に異常が出ると、背骨や肋骨に奇形が生じる。
正確な繰り返しパターンを実現する体節時計の実態は、個々の細胞の遺伝子発現の振動とその振動が細胞間で同調することで形成される波だということが、マウスやゼブラフィッシュを用いたこれまでの研究からわかっている。例えばマウスでは2時間周期の遺伝子振動波によって、2時間ごとに体節が形成されていく。一方、ヒトでの体節時計を研究するために、ヒトの胚を用いて研究することは非常に難しい。そこで、松田らはヒトiPS細胞を用いて体節時計を持つ組織(未分節中胚葉:PSM)の細胞を誘導し、体節時計の実態を観察した。すると、およそ5時間周期で遺伝子が振動していることがわかった。また、次世代シークエンサーを用いた解析から、多くの遺伝子の振動とともに、マウスと同様のシグナル伝達経路が振動していることがわかった。
試験管の中の体節時計を持つ組織は、脊椎肋骨異形成症の病態解析に利用できるだろうか。これまでの研究で報告されてきた脊椎肋骨異形成症の原因遺伝子(HES7、DLL3、LFNG、MESP2)を欠失したiPS細胞株を作製し、体節時計を持つ組織に現れる異常を観察した。その結果、HES7欠失株では遺伝子の振動が消失したが、驚いたことにその他の遺伝子の欠失株では野生株と差が見られなかった(図2上)。そこで、より実際の発生過程の状況に近くなるよう、3次元の体節時計誘導法を確立した。この細胞凝集塊を用いて振動遺伝子を観察すると、2次元誘導時とは異なり遺伝子発現の振動が波となって細胞間を伝わっていく移動波が観察された(動画)。これは実際の胚でも観察される体節時計の大きな特徴だ。この3次元誘導法を用いて原因遺伝子の欠損株から体節時計を誘導すると、DLL3欠失株とLFNG欠失株でも振動の速やかな消失が見られた(図2下)。この2つの遺伝子は、振動そのものよりも細胞間の同調に寄与していることがこれまでの研究で示唆されている。この3次元誘導系では、細胞が激しく動いて位置を変え、パターンを乱すので、野生型では正常な同調機構により移動波を保てるが、同調する力の弱まったDLL3欠失株とLFNG欠失株では、移動波が消失するのだと考えられる。つまり、ヒトの体節時計を再現するとともに、体節時計の重要な特徴である振動機構と同調機構を区別して評価する病態解析アッセイを確立したのだ。
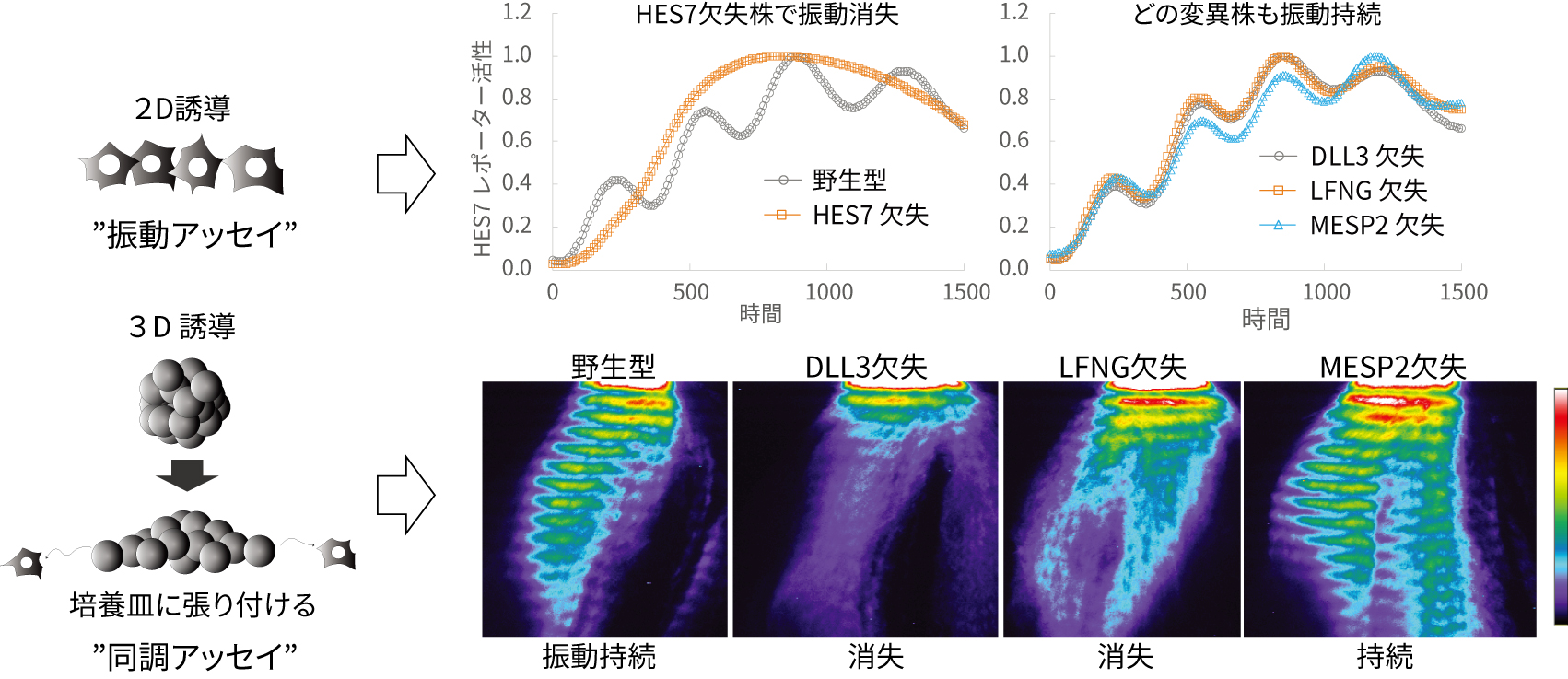
図2 体節時計の2つの性質である振動と同調を別々に評価できる病態解析アッセイを確立した。振動アッセイでは振動が
消失したのはHES7欠失株だけだったが、同調アッセイではDLL3欠失株とLFNG欠失株でも振動の消失が見られた。
一方、MESP2遺伝子は体節時計そのものではなく、体節時計によるパターン形成の後、体節に分化する際に働く遺伝子と考えられている。そこで未分節中胚葉の細胞から体節様細胞を誘導し、野生株とMESP2欠失株における遺伝子発現を比較し、MESP2欠失時に差が出る遺伝子マーカーを同定した。
この病態解析アッセイの有効性を、実際の脊椎肋骨異形成症の患者から得られたiPS細胞を用いて調べた。2人の患者由来のiPS細胞のDNA配列を調べたところ、それぞれDLL3遺伝子とMESP2遺伝子に変異が入っていた。これらの細胞株に対して病態解析アッセイを行ったところ、振動アッセイでは両方とも差が見られなかった。一方、DLL3変異株では同調アッセイに、MESP2変異株では体節様細胞での遺伝子発現に異常が見られた。これらの遺伝子変異を遺伝子操作によって正常に戻したところ、異常は見られなくなった。以上の結果から、この病態解析アッセイは実際の病気のモデルとして有効であることが示された。
「背骨や肋骨といった体幹部の構造のもとになる体節のパターン形成原理である体節時計を試験管内で再現することに成功しました。さらに、体節時計の重要な2つの性質である振動と同調を別々に評価することに成功しました。」と戎家ユニットリーダー(研究当時)は語る。「実は、脊椎肋骨異形成症の患者の多くは未だ原因遺伝子がわかっていません。今回確立された病態解析アッセイによって未知の原因遺伝子を発見することが今後の大きな目標です。」
高橋 涼香(BDR・広報グループ)
- *1: 本研究は以下の研究グループの共同研究で実施されました。
- 松田 充弘(理化学研究所 生命機能科学研究センター・研究員(研究当時))・筆頭著者
- 山中 良裕(京都大学大学院医学研究科・博士課程学生)・共同筆頭著者
- 齋藤 潤(京都大学iPS細胞研究所・准教授)
- 池川 志郎(理化学研究所 生命医科学研究センター・チームリーダー)
- 池谷 真(京都大学iPS細胞研究所・准教授)
- 川上 紀明(名城病院・脊椎脊髄センター長)
- 山本 拓也(京都大学iPS細胞研究所・准教授)
- Knut Woltjen(京都大学iPS細胞研究所・准教授)
- 戎家 美紀(理化学研究所 生命機能科学研究センター・ユニットリーダー(研究当時))・共同責任著者
- 戸口田 淳也(京都大学iPS細胞研究所・教授)
- Cantas Alev(京都大学iPS細胞研究所・助教(研究当時))・責任著者
関連リンク
掲載された論文
関連記事





