神経細胞で軸索を一本だけにする仕組み
2018年11月12日
神経細胞には1本の長い軸索がある。軸索の中には微小管が通っていて、神経細胞の細胞体から末端に向けて、あるいは逆方向に、物質の輸送を行っている。教科書にも軸索は1本と書いてあるが、どうして1本だけなのだろう。神経細胞の初代培養を行うと複数の突起が生じるが、そのうちの一つだけが長く伸びて軸索となり、他は樹状突起となる。このとき、微小管を構成するチューブリンの脱重合を人為的に阻害すると、軸索が複数形成されることが知られている。また、軸索の微小管は樹状突起の微小管よりも安定であるという報告もある。したがって、単一の軸索形成と微小管の安定化には関連があるのではないかと考えられているが、詳しいことはわかっていない。
理研BDRのVarisa Pongrakhananon(ヴァリサ・ポングラカナノン)研究員(高次構造形成研究チーム、竹市雅俊TL)らは、CAMSAP3が海馬の神経細胞において、軸索の微小管の安定性を制御することによって、軸索の数を増やさないように働いていることを明らかにした。本成果は科学誌 Proceedings of the National Academy of Sciencesに2018年9月6日付で掲載された。
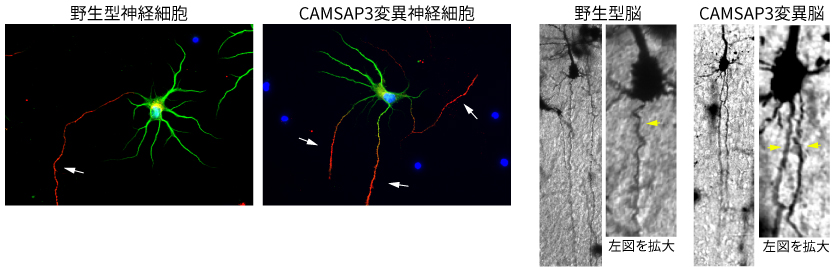
(左)CAMSAP3変異マウスの海馬神経細胞を培養すると、軸索(矢印)が複数形成された。(緑:樹状突起、赤:軸索、青:核)
(右)CAMSAP3変異マウスの脳(帯状皮質)では、複数の軸索(矢印)を持つ神経細胞が観察された。
研究チームは中心体と結合していない微小管のマイナス端に結合するタンパク質CAMSAP3(当初Nezhaと呼ぶ)を2008年に発見、その後、CAMSAP3が上皮細胞における微小管の配向に重要な役割を果たしていることなどを報告してきた。また、類似タンパク質CAMSAP2が樹状突起形成に関与することや、線虫の相同分子PTN-1が軸索形成や再生に重要であることが他の研究グループによって示されている。そこでPongrakhananonらは、CAMSAP3変異マウスを用いて、海馬神経細胞における軸索形成におけるCAMSAP3の機能を明らかにしようと試みた。
まず、海馬神経細胞におけるCAMSAP2とCAMSAP3の局在を調べると、CAMSAP2が軸索と樹状突起の両方に分布しているのに対し、CAMSAP3は軸索に集まっていた。軸索形成におけるCAMSAP3の役割を明らかにするために、微小管のマイナス端に結合するために必要なC末端の切断型CAMSAP3を発現するCamsap3dc/dcマウスや、CAMSAP3を欠失したマウスを用いて、これらのマウスの海馬神経細胞を培養すると、ある頻度で複数の軸索が形成された。また、Camsap3dc/dcマウスの脳切片でも複数の軸索を持つ神経細胞が観察されたが、野生型の脳では認められなかった。したがって、CAMSAP3は軸索の数を1本だけに抑えるよう働いていると考えられた。
では、CAMSAP3はどのようにして軸索を一本だけにするのだろうか。微小管を薬剤で過剰に安定化すると複数の軸索が形成されることが知られているので、CAMSAP3の欠失により微小管の安定化が促進されているのではないかと考えた。そこで、安定な微小管だけに起きるとされる化学修飾アセチル化を指標として、CAMSAP3のあるとき・ないときの微小管の安定性を調べた。まず、マウス神経芽細胞腫細胞株Neuro2aを使い、CAMSAP3をRNAiにより除去すると、チューブリンのアセチル化が亢進し、同時に、神経突起の形成が促進された。逆に、海馬神経細胞などでCAMSAP3を過剰発現すると、アセチル化が減少した。したがって、CAMSAP3が機能しないと微小管の安定性が向上し、その結果、複数の軸索が形成されるのではないかと考えられた。
海馬神経細胞においては、CAMSAP3の機能を欠損させても、アセチル化チューブリンの全量には変化が検出されなかった。しかし、CAMSAP3の軸索内分布を調べると、動的とされるチロシン化微小管とは共局在するが、アセチル化微小管を避けていた。つまり、軸索においては、多くの微小管が安定化する中、CAMSAP3は少数の微小管の動的な状態を保つために働いており、これが、軸索の過剰形成を抑えている可能性が示唆された。
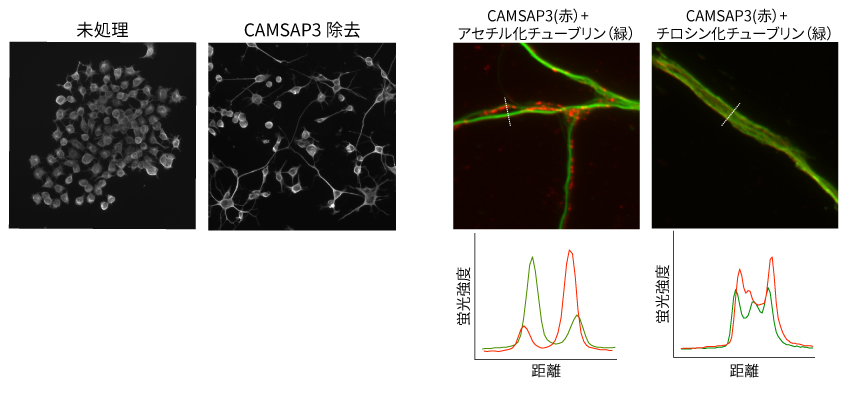
(左)Neuro2a細胞でCAMSAP3を除去すると突起が伸びる。 (右)培養した海馬神経の軸索におけるCAMSAP3とアセチル化チューブリンおよびチロシン化チューブリンの分布。グラフは点線に沿った蛍光強度。CAMSAP3が存在する領域ではチューブリンのアセチル化が抑制される傾向がある。
「CAMSAP3による一部の微小管の安定性制御が、軸索の数を1本だけに抑えていると結論されました。」と竹市チームリーダーは語る。「しかし、CAMSAP3がどのように微小管の動態を制御しているかについてのメカニズムはまだわかりません。また、軸索形成の仕組み自体は、今回の研究では解けていません。簡単なようで難しい問題ですね。」
高橋 涼香(BDR・広報グループ)
関連リンク
掲載された論文





