「ゆらぎの定理」から、細胞内での軸索輸送にかかる力を測定できる
2019年3月20日
神経細胞の軸索は非常に長い。一番長いものは1m程度ある。細胞体で合成されたタンパク質のうち、軸索の先端で機能するものはその長い軸索の中を分子モーターであるキネシンによって輸送されていく。また、軸索の先端で受け取る神経栄養因子は、もう一つの分子モーターであるダイニンによって細胞体に輸送され、神経細胞が適切に生存できるようになる。分子モーターが適切な速度で積荷を輸送することが生物学的にも機能的にも重要であることは様々な研究で示されており、例えば輸送速度が低下するキネシンの変異は、下肢の麻痺を呈する遺伝性痙性対麻痺の原因となる。しかし、キネシンの移動速度についてはin vitroとin vivoで異なる報告がなされている。in vitroでキネシンの移動速度を測定すると、約1μm/sなのだが、軸索内で移動速度を測定するとだいたい5μm/sとなるのだ。抵抗がほとんどないin vitroよりも、細胞内混雑によって抵抗力がかかっているであろうin vivoの方がキネシンの移動速度が速いのは、なぜなのだろうか。
理研BDRの岡田康志チームリーダー(細胞極性統御研究チーム)と東北大学の林久美子准教授らは、高速高分解能イメージングと非平衡系における「ゆらぎの定理」を組み合わせることで、細胞内の力を非侵襲的に測定できることを明らかにした。本成果は科学誌 Molecular Biology of the Cell に2018年12月3日付で掲載された。
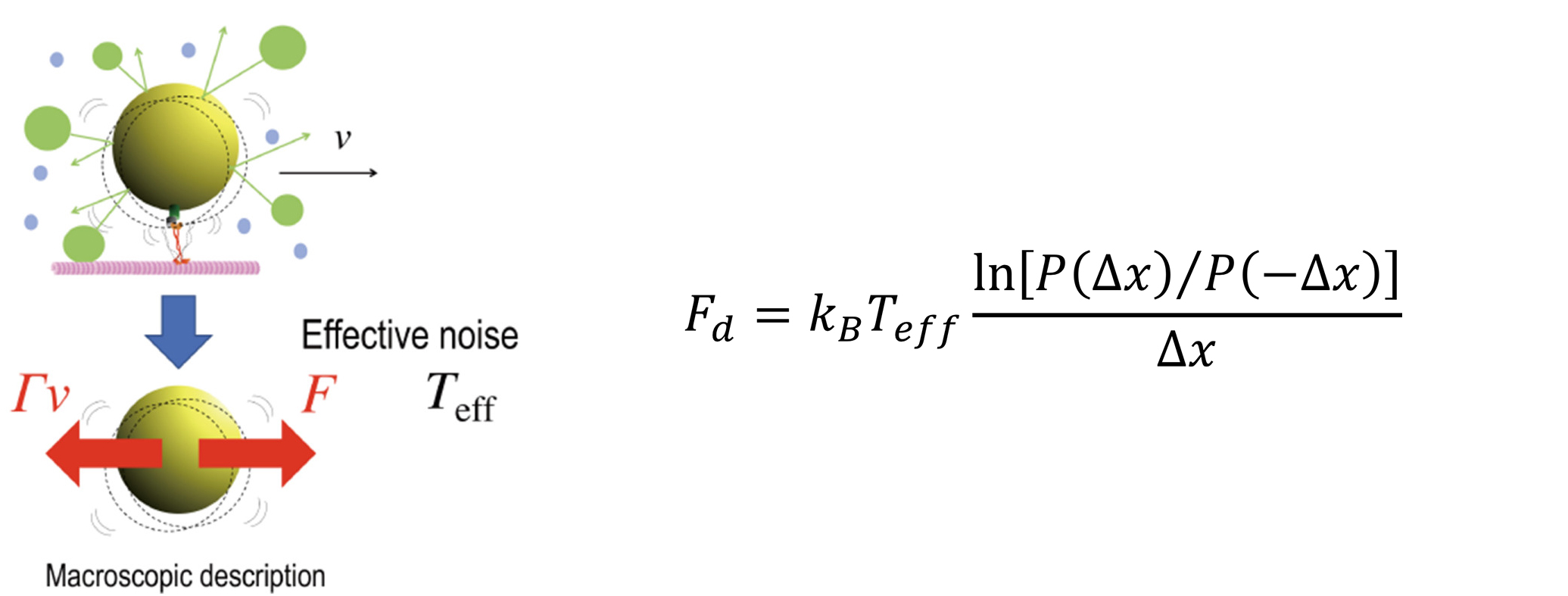
本論文で用いた「ゆらぎの定理」。抵抗力Fdはゆらぎln[P(⊿x)/P(-⊿x)]から求められる。
なぜキネシンの移動速度がin vitroとin vivoで5倍も違うのだろうか。速度を上げるためには、(1)分子モーターの数を増やす、(2)移動のためのエネルギーを得るATP加水分解反応1回あたりの移動距離を増やす(ATPから得られるエネルギーは一定なので、距離が増えれば力が小さくなる)、 (3) ATP加水分解の反応速度を上げる(小胞にかかる力は変化しない)、のいずれかが細胞内で起こっているはずだ。その謎を解くために、岡田らは細胞内で輸送小胞にかかる力を測定したいと考えた。しかし、細胞の中で力を直接測ることはできない。そこで、岡田らは、小胞の動きを観察するだけで力を測定できる方法として、「ゆらぎの定理」に注目した。ゆらぎの定理は、約100年前に水中の微粒子のブラウン運動(ゆらぎ)の研究から導かれたアインシュタイン関係式を一般化したもので、2000年前後に様々な形式で証明された。この研究では、林が大学院生の時に証明した、周囲の分子と衝突しながら微粒子が動くときの微粒子に働く力と速度のゆらぎの関係を表す関係式が使われた。
まず、マウスの神経細胞を培養し、細胞内のエンドソームを蛍光標識して軸索輸送を時間分解能10ms、位置精度8nmの高速高分解能イメージングで観察した。キネシンは1回のATP加水分解で8nm前進し、1秒間に約100回の加水分解をすることがわかっているため、このイメージングではATP加水分解1回あたりのキネシンの1ステップの運動に相当する精度で観察できる。そのような高精度でエンドソームの動きを観察すると、従来の観察では一定速度の運動に見える部分でも、その動きにゆらぎがあることが計測できる。このゆらぎを「ゆらぎの定理」に従って解析し、エンドソームにかかる力を求めた。
その結果、エンドソームにかかる力の単位は約5pNが1単位であった。これは水中でエンドソームと同じ大きさの微粒子が動くときにかかる力の1000倍程度である。細胞の中はタンパク質などの分子が高濃度で存在している混雑環境であるため、エンドソームが分子で混雑した中をかき分けながら動くには大きな抵抗力がかかるのだろうと理解できる。また、エンドソームにかかる力が5pN、10pN、15pNと離散的な分布を示すことから、エンドソームに駆動力を与えるユニットがそれぞれ1個、2個、3個に相当すると考えられる。キネシンが細胞体から軸索末端へと運ぶエンドソームは、ユニットが1~4個で平均2ユニット。ダイニンが軸索末端から細胞体へと運ぶエンドソームでは、平均1.5ユニットであった。以前の報告から、エンドソーム1個にキネシンは平均2分子、ダイニンは平均3分子結合していることがわかっている。このことを合わせて考えると、キネシンは1分子が1ユニットに相当しているが、ダイニンは2分子が1ユニットに相当すると予想される。実際に、クライオ電子顕微鏡を用いた構造解析によって、ダイニンはアダプター分子を介して2分子のダイニンがペアになって小胞と結合していることが最近報告されており、この予想が証明された。
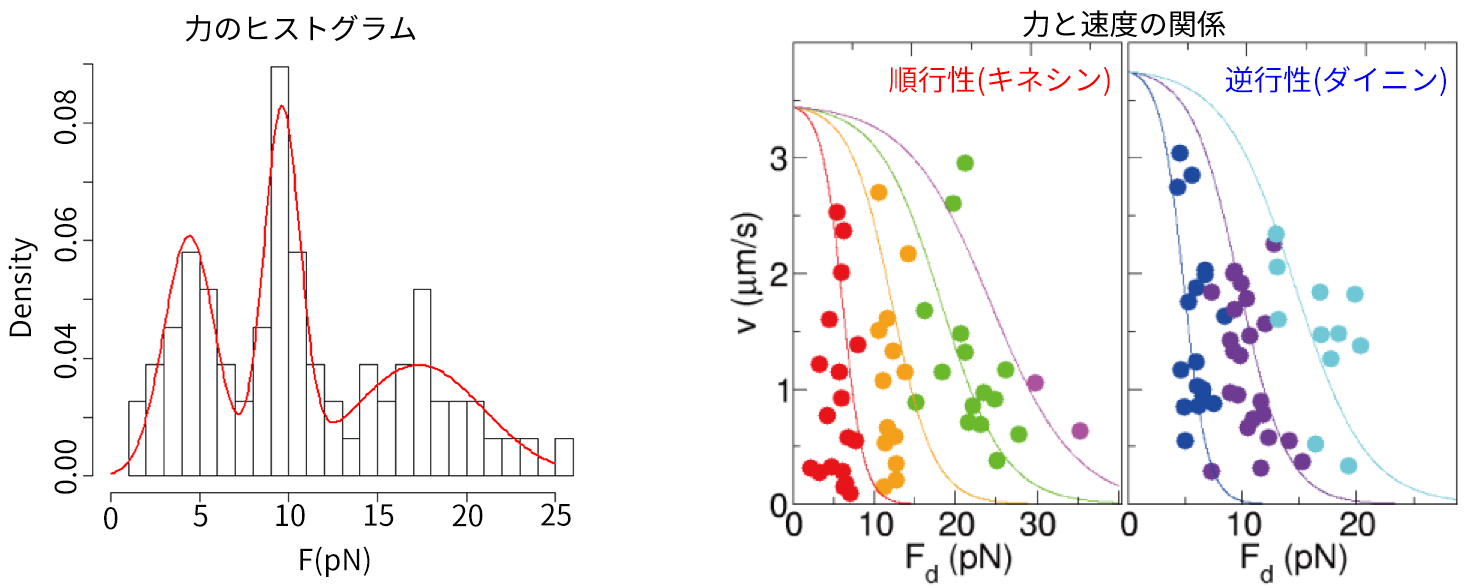
(左)観察結果とゆらぎの定理から求められる小胞にかかる力のヒストグラム。5pNが1単位となっている。(右)順行性小胞に結合するキネシンが1分子(赤)、2分子(オレンジ)、3分子(黄緑)、4分子(藤色)の時、および逆行性小胞に結合するダイニンが1分子(青)、2分子(紫)、3分子(水色)の時の、力Fdと速度vの関係を示す。それぞれドットは観察により得られた実測値で、近似曲線はin vitroにおける速度と力の関係を速度だけ4倍にしたもの。
では、最初の疑問に戻ろう。なぜキネシンは、in vitroよりもin vivoのほうが5倍も速く移動できるのだろうか。今回の観察から、一つの小胞には最大4分子のキネシンが結合していることがわかったが、速度との関係では1分子で輸送するときも4分子で輸送するときも速度に変化はなかった。したがって、キネシンの数を増やして速度を上げているわけではないようだ。一方、in vitroで得られる速度と力の関係について、速度だけを4倍にするとin vivoでの測定結果に近似することがわかった。つまり、キネシンによる移動速度を力の関係をin vitroとin vivoを比較すると、力は変化せずに速度だけ4倍になっているということである。つまり、小胞にかかる力は変化させずにATP加水分解の反応速度を上げることによって、移動速度を上げているものと考えられる。
「高速高分解能イメージングとゆらぎの定理を組み合わせることによって、細胞内で力を測定できるようになりました。この方法は非侵襲的なので、ヒトのサンプルなど応用範囲が非常に広いものです。」と岡田チームリーダーは語る。「今回の結果から、in vitroとin vivoではタンパク質の反応速度が違っている可能性が示唆されました。細胞内での分子の反応速度を明らかにする手法は、まだありません。キネシンの移動速度の謎を完全に解くために、反応速度を観察できる顕微鏡を開発したいと考えています。」
高橋 涼香(BDR・広報グループ)
関連リンク
掲載された論文





