理想的な11C-標識ロイシンの化学合成法を開発
2022年6月15日
アミノ酸は生体内で多種多様な生命現象を支える重要な物質だ。中でも、分岐状の脂肪族側鎖を持つロイシンやイソロイシン、バリン(分岐鎖アミノ酸)は、ヒトの体内で生合成できないので、食品から摂取しなくてはならない。しかし、生体内のタンパク質成分の約20%を占め、生命機能の発現や生体恒常性の維持など重要な役割を担っている。生体内で活動するこれらの分子の挙動を追跡することができれば、妙なる生命現象の理解と解明につながる。
理研BDRの髙谷修平研究員(標識化学研究チーム、土居久志チームリーダー)らの共同研究グループ*1は、独自の高速11C-メチル化法とフロー式水素化法を組み合わせた連続的化学合成法を開発し、これまで実現が困難だったL-ロイシンの炭素骨格5位末端に陽電子放出核種である炭素11で標識することに成功した。本成果は理想的なロイシンの11C-標識法として科学誌ChemMedChemに2021年11月5日付で掲載された(特別重要論文に選定)。
陽電子放射断層画像撮影法(positron emission tomography: PET)とは、たとえば、薬剤や食品成分の化学構造に放射性の陽電子放出核種で標識し(PETプローブ)、これを生体に投与してPETプローブから放出される放射線を生体外から撮影して、生体内での挙動をリアルタイムで観察できるイメージング技術である。たとえばL-ロイシンは、細胞内タンパク質の代謝調整などの生命の本質的かつ主導的な機能を持つ。そこでPET分野では、これまでL-ロイシンの生体内動態を観測する研究が盛んに行われてきた。とくに、L-ロイシンの1位カルボン酸を11Cで標識したL-[1-11C]ロイシンが開発され、脳内タンパク質合成に関わる高次脳機能イメージングや脳内軟膜血管腫などの臨床PET研究で広く使用されてきた。しかしながら、このL-[1-11C]ロイシンは代謝によって脱炭酸を受け、標識部位が[11C]二酸化炭素として脱離してしまうため、得られたPET画像の信憑性には懸念が示されていた。
この問題を克服するために、髙谷らは汎用性の高い[11C]ヨウ化メチル([11C]CH3I)を標識原料として、ロイシンの炭素骨格の5位末端を炭素-炭素結合形式により11C-標識することを計画した。まず、光学的に純粋なアルケニルホウ素前駆体(S)-1および(S)-2に対して、標識化学研究チーム独自の高速11C-メチル化法(パラジウム触媒を用いた[11C]CH3Iと有機ホウ素化合物とのクロスカップリング反応)により、わずか5分でアルケン部位に[11C]メチル基を導入し、続いて、H-Cube®*2を用いたフロー式水素化法により、アルケン部位の水素還元と脱保護反応(ベンジル基とベンジルオキシカルボニル基の除去)を同時に行った。その結果、全工程を40分以内で目的のL-[5-11C]ロイシン、および人工アミノ酸であるL-α-[5-11C]メチルロイシンの合成に成功した(単離放射能:0.6–2.7 GBq, 比放射能:60–200 GBq/µmol, 放射化学収率:6–38%)。これら11C-標識体の化学純度は95%以上、放射化学純度は95%以上、鏡像体過剰率は99% eeであった。また11C-標識ロイシンの生体投与液を調製し、その溶液中に含まれる残留パラジウム量を測定した結果、注射溶液あたりの国際的なヒト投与基準(10 µg/day)よりも十分に低い値(10–20 ng)であった。以上の結果から、本法で合成した11C-標識ロイシンは将来的な臨床PET研究にも適用可能であることを確認した。
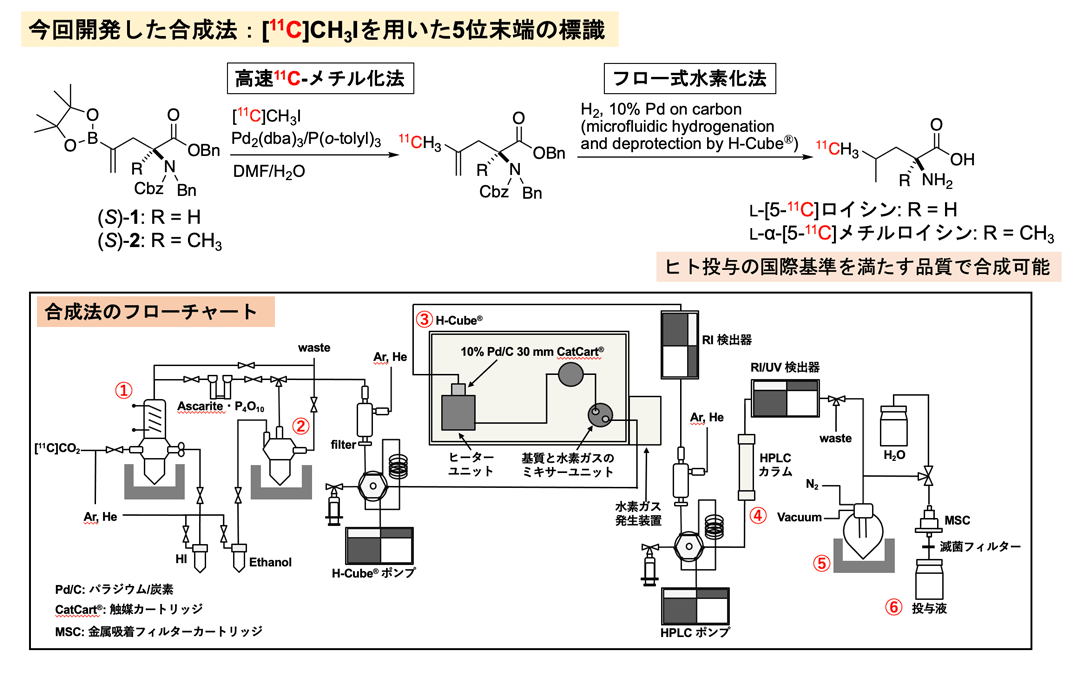
図1. 新規11C-標識ロイシン化学合成法の概要
上段:高速11C-メチル化法とフロー式水素化法を組み合わせた連続的合成プロセスによる11C-標識ロイシンの合成
下段:11C-標識ロイシン合成法のフローチャート。①:サイクロトロンで製造した[11C]二酸化炭素([11C]CO2)を[11C]ヨウ化メチル([11C]CH3I)に化学変換(水素化リチウムアルミニウムによる還元と、続くヨウ化水素酸を用いたヨウ素化)。②:高速11C-メチル化法{蒸留により移送した[11C]CH3Iと、アルケニルホウ素前駆体(S)-1または(S)-2とのパラジウム触媒によるクロスカップリング反応}。③:フロー式水素化法(H-Cube®によるアルケンの水素還元と、ベンジル基とベンジルオキシカルボニル基の水素化による除去)。④:分取HPLCによる分離・精製。⑤:減圧蒸留による濃縮。⑥:生体投与液の調製。
次に、がん組織への集積について検討した。今回合成したL-[5-11C]ロイシンおよびL-α-[5-11C]メチルロイシンと、現在PETがん診断で使用されているL-[メチル-11C]メチオニンを、ヒト扁平上皮がん(A431細胞)を移植したマウスに尾静脈投与し、投与後30分から60分まで全身をPET撮像した。その結果、いずれの11C-標識体もがん組織に集積した。中でも、L-α-[5-11C]メチルロイシンはがん組織により多く集積していた。また投与60分後にがん組織に取り込まれた放射能を調査した結果、L-α-[5-11C]メチルロイシンは、L-[メチル-11C]メチオニンやL-[5-11C]ロイシンに比べて約2倍高くがん組織に集積していることがわかった(12 ± 3% ID/g*3)。
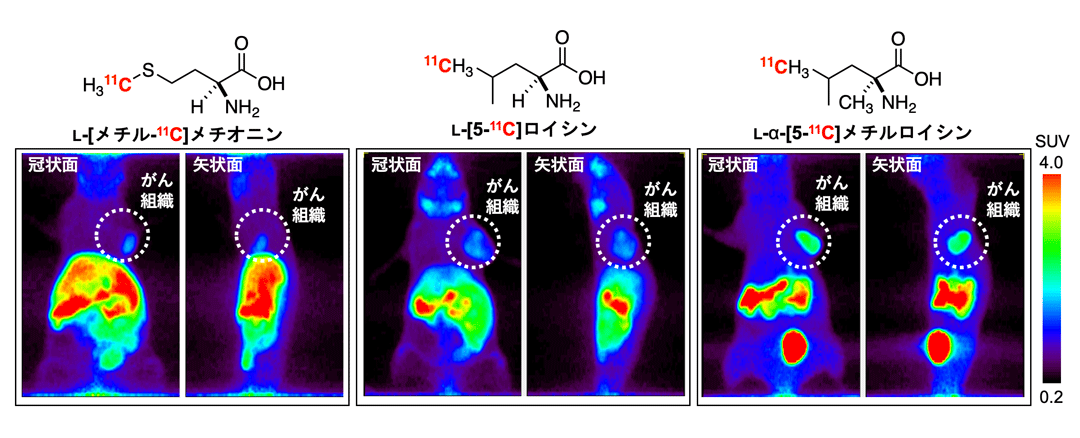
図2. A431担がんマウスのPETイメージング結果
L-[メチル-11C]メチオニン、L-[5-11C]ロイシン、L-α-[5-11C]メチルロイシンをそれぞれ投与したA431担がんマウスの投与後30分から60分までの全身PET画像。Standardized Uptake Value: SUVは、関心領域における放射能(Bq/mL)と、投与したPETプローブの放射能(Bq)と動物の体重(g)の比率を表す。
「今回新たに合成したL-α-[5-11C]メチルロイシンは、がん組織に顕著に集積するため、将来的にはヒトを対象とした画像診断薬として有効かもしれません。」と髙谷研究員は語る。「今後は、今回開発した合成法をPET臨床研究を実施している医学部病院等に技術移管・技術指導をしていきます。また、鏡像体であるD-ロイシン(てんかん発作や興奮性の脳機能障害の抑制機能を持つ)の合成への展開や、イソプロピル基やイソブチル基などの分枝アルキル基を含む生物活性有機化合物の11C-標識化へと適用範囲を広げていきたいと考えています。」
高橋 涼香(BDR・広報グループ)
- *1本研究は以下の研究グループの共同研究で実施されました。
- 髙谷修平研究員(理化学研究所生命機能科学研究センター標識化学研究チーム)
- 田原強准教授(徳島大学先端研究推進センターバイオイメージング研究部門in vivoイメージング分野、元理化学研究所生命機能科学研究センター研究員)
- 尾上浩隆特定教授(京都大学大学院医学研究科附属脳機能総合研究センター、元理化学研究所ライフサイエンス技術基盤研究センターチームリーダー)
- 渡辺恭良チームリーダー(理化学研究所生命機能科学研究センター健康・病態科学研究チーム)
- 土居久志チームリーダー(理化学研究所生命機能科学研究センター標識化学研究チーム)
- *2 H-Cube®は、パラジウム等の触媒カートリッジを組み込んだマイクロ流体水素化装置であり、水の電気分解で発生した水素を用いて、危険な水素化反応を安全に実施できる。
- *3% injected dose/gram tissue:% ID/gは、ある組織における放射性化合物の集積指標。
関連リンク
掲載された論文





