がんエピゲノムのヒストンの高アセチル化は頑強だった
2018年8月20日
真核生物のゲノムDNAは、核内でヒストンに巻きついた凝縮構造を形成している。ヒストンはヒストンテイルと呼ばれるN末端領域にアセチル化やメチル化などの様々な化学修飾を受けて、エピゲノム情報の実体を担っている。ヒトをはじめとする真核生物の遺伝子発現においてはヒストンH4のリシン残基のアセチル化が重要であり、特にN末端領域の端まで複数のリシン残基がアセチル化されたヒストンH4の高アセチル化状態はがん遺伝子の発現制御に関わっている。しかし、エピゲノムにおいて高アセチル化ヒストンH4の分布を特異的に検出する手法はこれまで開発されていなかった。
理研BDRの梅原崇史ユニットリーダー(エピジェネティクス制御研究ユニット)と理研IMSの蓑田亜希子ユニットリーダー(エピゲノム技術開発ユニット)らは、高アセチル化ヒストンH4を特異的に検出する抗体を作製し、肺がん細胞株のエピゲノムにおける高アセチル化ヒストンH4の分布を明らかにした。また、高アセチル化H4に結合するタンパク質を標的とする抗がん剤がヒストンの高アセチル化状態には影響を及ぼさないことを見出した。本成果は科学誌Epigeneticsに2018年8月6日付で掲載された。
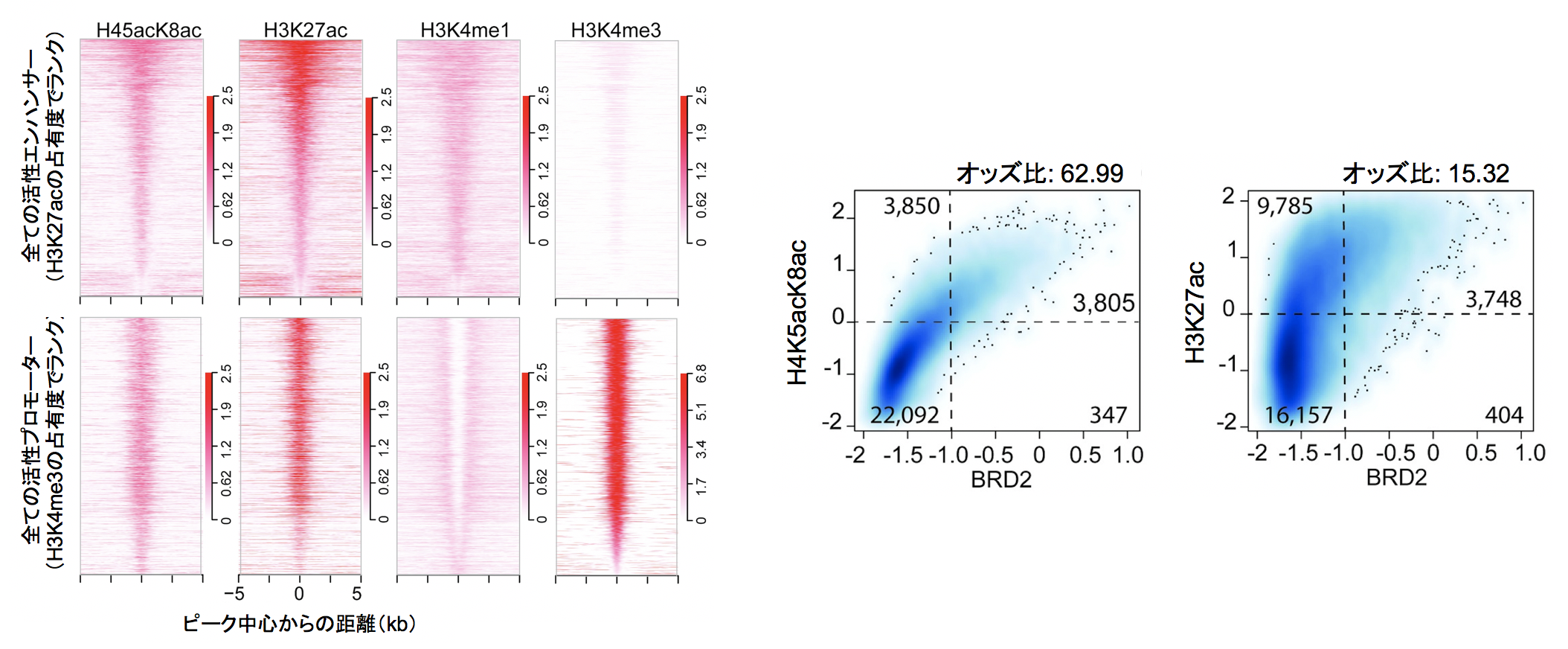
図1 (左)ヒト肺がん細胞株H23のエンハンサー領域またはプロモーター領域におけるエピゲノム修飾の可視化マップ。H4K5acK8acはエンハンサーおよびプロモーターの両方に分布しており、またH3K4me1、H3K4me3H3よりもH3K27acの局在と一致している。(右) BETファミリータンパク質BRD2とH4K5acK8acおよびH3K27acとの共局在密度プロット。BRD2との共局在は、H4K5acK8acの方がH3K27acよりも高く相関する。
遺伝子発現の活性化に影響するヒストンH4のアセチル化は、ヒストンテイルに存在する4つのリシン残基(K5、K8、K12、K16)に対して可逆的に行われる。このアセチル化のパターンは転写制御に重要であり、哺乳類ではブロモドメインの繰り返し配列と余剰末端を持つBET(bromodomain and extra-terminal domain)ファミリータンパク質が、N末端領域の端まで複数のリシン残基がアセチル化された状態(K5とK8の両アセチル化)に特異的に結合し、がん関連遺伝子の発現制御に関与することが多くのがん細胞株で報告されている。しかし、単一のリシン残基がアセチル化されたヒストンを認識する抗体は存在するものの、特定の複数のリシン残基がアセチル化された高アセチル化パターンのヒストンを特異的に認識する抗体はなかった。そのため、細胞内のエピゲノムにおける高アセチル化ヒストンの分布やBETファミリータンパク質が作用したり阻害されたりした時の高アセチル化ヒストンの挙動などは不明だった。
そこで、梅原らはヒストンH4のK5とK8がアセチル化された状態(H4K5acK8ac)を特異的に認識するモノクローナル抗体の作製を試みた。最初に、タンパク質の無細胞合成技術と遺伝暗号の拡張技術を組み合わせることにより、タンパク質の翻訳段階においてK5とK8の残基にアセチル化リシンを選択的に導入した完全長の高アセチル化ヒストンH4タンパク質を合成した。この高アセチル化タンパク質を抗原としてマウスを免疫し、ハイブリドーマのスクリーニングにより得られた抗体2A7D9の結晶構造を解析した。その結果、抗体重鎖の可変領域に存在するA54がH4K5acK8acの特異的な認識に重要なアミノ酸であることがわかった。次に、この抗H4K5acK8ac抗体2A7D9を用いたChIP-seqにより、肺がん細胞株H23におけるH4K5acK8acのエピゲノム分布を調べた。その結果、H4K5acK8acは活性化エンハンサーや活性化プロモーターを含む転写活性化領域に分布していた。この分布は、活性化エンハンサー/プロモーターのヒストン修飾マークとして一般的に認識されているH3K27acの局在と強い相関があった。そこで、BETファミリータンパク質の1種であるBRD2がH4K5acK8acとH3K27acのどちらとより共局在するかをChIP-seqにより解析した。その結果、エピゲノムにおいてBRD2はH3K27acよりもH4K5acK8acと共局在することが明らかとなり、H4K5acK8acがH3K27acと同等以上の活性化エンハンサー/プロモーターのヒストン修飾マークとして利用可能であることがわかった。
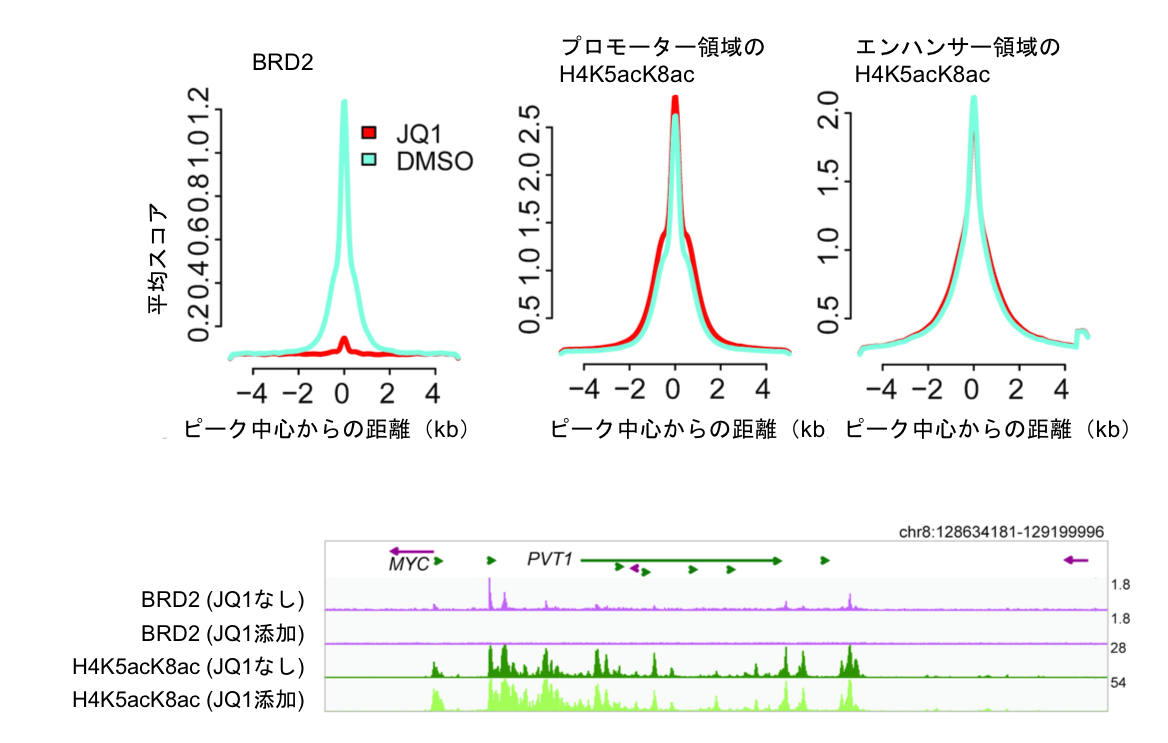
図2 BET阻害剤JQ1で肺がん細胞株を処理すると、BRD2はエピゲノムからほぼ完全に遊離するが、H4K5acK8acの修飾マークはまったく影響されない。
BETファミリータンパク質はがん関連遺伝子の転写調節に働くことから、現在多くの製薬会社において重要な創薬標的分子と位置づけられている。例えばJQ1と呼ばれる低分子化合物は、BETファミリータンパク質のアセチル化リシン認識ポケットに結合して、本来の結合相手であるアセチル化ヒストンへの結合を遮断し、一定のがん抑制効果を示す。しかしこの時、BETファミリータンパク質がもともと結合していたヒストンのアセチル化パターンが変化するかどうかについては不明であった。ヒト肺がん細胞株H23をJQ1で処理すると、BRD2はほぼ完全にエピゲノムから遊離したが、H4K5acK8acの修飾マークはプロモーター領域においてもエンハンサー領域においてもはほとんど影響を受けないことがわかった。
「ヒストンH4の高アセチル化状態を特異的に検出できたことで、抗がん剤を投与してもがん細胞のエピゲノムの高アセチル化状態が頑強に変化しないことがわかりました」と梅原ユニットリーダーは語る。「従って、がんを根本的に治療するためにはエピゲノム結合タンパク質を一時的に遊離させるだけではなく、エピゲノムの化学修飾そのものを変化させる必要があると考えられます。今後は、抗がん剤の併用効果などを検討していくことにより、がん細胞で頑強に維持されるヒストンの高アセチル化状態をいかに変化させるかなどの問題解決に合理的にアプローチできると考えられます」。
高橋 涼香(BDR・広報グループ)
関連リンク
掲載された論文
関連記事




